Хроматография – современный и высокоэффективный метод, позволяющий достаточно быстро и надежно определять содержание отдельных компонентов в смесях, концентрировать и идентифицировать эти компоненты. Она эффективна не только в химическом анализе, но и в химической технологии.
Наибольшее значение при этом имеет оценка содержания, состояния, структуры, комплексообразования и распределения белков. Для установления этих характеристик нужно прежде всего, обеспечить ненарушение выделения из аналита характерного данного нативного белка. Для этого в химии белков предложен ряд методов; высаливание, избирательное осаждение, ультрацентрифугирование, диализ, электрофорез и т.д.
Одним из методов выделения, разделения и аналитического определения белков является предложенный впервые в 1959 году метод гель-проникающей хроматографии (молекулярно-ситовой процесс). Этот метод считается в настоящее время важнейшим и эффективнейшим способом разделения белков, т.к. он отличается рядом необходимых особенностей; независимость от рН Среды, температуры, сохранение нативных состава и структуры.
Обычно применяется колоночный вариант этого метода, отличающийся громоздкостью аппаратуры, употреблением больших количеств дорогих и труднодоступных реактивов, длительностью аналитической процедуры (порядка нескольких суток на один анализ). Предложен и используется в некоторых странах другой вариант метода ГПХ – тонкослойный планарный (ТС ГПХ). Он отличается достоинствами во всех тех отношениях, в которых имеет недостатки колоночный метод, но и сам содержит ряд трудностей.
Изменение содержания минеральных веществ (элементно-концентрационного состава) почв в значительной степени соответствует изменению молекулярно-массового состава биополимеров (белков) в исследуемых образцах зерновых культур и продуктов их переработки (муке) в зависимости от экологической ситуации. С целью исследования молекулярно-массового распределения белковых фракций зерновых культур и муки был применен метод планарной гель-проникающей хроматографии (ПГПХ).
Несомненными достоинствами ПГПХ являются: возможность сохранения нативных состава и структуры белка; независимость от температуры и рН среды, в которой проводится определение и возможности использования органических растворителей [1].
В исследованиях мы использовали герметичную камеру из полиэтилена высокой плотности с покрытием из органического стекла, в которой имеется щель для нанесения исследуемых образцов. Верхняя часть камеры подвижна и снабжена устройством для фиксации ее под определенным углом к горизонтальной плоскости. Внутри камеры есть четыре резервуара для заполнения их элюентом. Между резервуарами закрепляли пластину, покрытую слоем суспензии набухшего геля, которая соединялась с резервуарами с помощью «мостиков» из фильтровальной бумаги. Резервуары заполняли элюентом: верхний, в зависимости от угла наклона камеры, от 0,5 до 0,7 объема чтобы избежать переливания через край: средние два – от 0,3до 0,4 объема; нижний – до 0,2 объема для увлажнения «мостика» из фильтровальной бумаги. Исследования в условиях ПГПХ проводили на стеклянных пластинах размером 100×200 и 200×200 мм с закрепленными по краям вдоль пластины полосками из тонкой (0,3–0,6 мм) резины.
Для планарной ГПХ в первую очередь встает вопрос об оптимальной способности геля к образованию прочного адгезионного слоя на поверхности пластин. Эти способности зависят от размеров зерна, их пористости и сольватационных свойств частиц геля [2].
По техническим характеристикам Сефадексы «Суперфайн» более подходят для разрабатываемой нами методики, чем другие декстрановые гели или биогель Р, имеющий меньший интервал фракционирования и более крупные размеры гранул.
Самым большим преимуществом гельпроникающей хроматографии в тонком слое является то, что несколько образцов могут располагаться рядом на пластине и может производиться их непосредственное сравнение, в том числе и со стандартными образцами.
Отношение между толщиной слоя, углом наклона, пористостью геля, скоростью потока растворителя дает возможность устанавливать оптимальную аналитическую технологию, пользуясь обычным в технике методом проб и ошибок. В основном толщина слоя порядка 0,5 мм, скорость потока около 3 см/ч и угол наклона от 10 до 20° являются наиболее оптимальными. Более высокая скорость потока может вызывать расширение зон и неполноценное расширение. Для Сефадексов G-100, G-200 скорость потока между 2 и 5 см/ч достигается при толщине слоя 0,6 мм и угле наклона от 10 до 30°. Однако на Сефадексах G-50, G-75 такая же скорость потока может быть получена и с меньшим углом.
Экспериментальная часть
Анализ белковых фракций, содержащихся в зерновых культурах и муке, проводился следующим образом. Образцы, содержащие не более 100 мкг исследуемого вещества в объеме около 1–3 мкл, нанесли на стартовую линию микропипеткой (капилляром) в виде капли (пятно диаметром 2–5 мм), не прикасаясь к поверхности, для избежания повреждения слоя. Камеру с пластинками (2–4 штук) устанавливали в нужное положение (15–20°) и выдерживали в течение 1–3 часов [3].
Поскольку при элюировании фронт растворителя неразличим, скорость движения растворителя определяли и регулировали с помощью соединений-маркеров. Для этой цели использовали окрашенные белки природного происхождения, например гемоглобин и цитохром «С», или же белки с флуоресцентной меткой, присоединенной, с помощью флуоресцеинизотиоцианата. Однако, наиболее подходящими и хорошо различимыми маркерами являются, по-видимому, бычий сывороточный альбумин и альбумин человека, окрашенные амидочерным 10Б. Результаты переснимались на хроматографическую бумагу, с последующим детектированием биополимеров 0,02 %-м раствором амидочерного 10Б в смеси этанол ‒ уксусная кислота ‒ вода (5:4:1). Лист бумаги, соответствующий размерам слоя геля на пластинке, помещали на слой геля и быстрым движением пластмассового стержня, начиная от края пластинки, прижимали его к слою, удаляя тем самым пузырьки воздуха между бумагой и гелем. Через 5 минут компоненты смеси были полностью перенесены на бумагу. Бумагу снимали, иногда вместе с частью геля, затем бумажные реплики высушивали в сушильном шкафу при температуре 120 °С в течение 5 минут и отмывали в той же смеси без красителя.
Опытным путем нами был выбран для окрашивания белковых комплексов амидочерный 10Б, так как он дает ярко прокрашенные, устойчивые пятна.
Единственным его недостатком является остающийся после отмывания отпечатков светло-голубой фон, который, однако, не влияет на качество определения [4].
Нами было изучено влияние ряда факторов на процесс разделения белка на пластине (время продолжительности анализа, угла наклона камеры, марка используемого Сефадекса). Оптимизация совокупности этих параметров позволяла достичь нужной скорости миграции определяемых веществ (1–5 см/ч).
Нами проведены исследования Сефадексов марки G-50, G-75, G-100, G-200 «Суперфайл» при различных углах наклона камеры, которые варьировались от 10 до 20°. Расстояние стандартных белков от линии старта замеряли через определенные промежутки времени от 0 до 4 часов. Величину молекулярных масс (ММ) определяли по стандартным белкам, в качестве которых применяли: инсулин (цепь Б), с ММ 5800, рибонуклеазу с ММ 13700; химотрипсин с ММ 25000; трипсин с ММ 25500; овальбумин с ММ 45000; бычий сывороточный альбумин с ММ 67000; цитохром «С» с ММ 13000, актрапид, холестерин. Элюирующими системами были фосфатный буфер, раствор хлорида натрия и вода. После проведенных исследований устанавливали прямую зависимость скорости миграции веществ от угла наклона камеры. Чем больше был угол наклона, тем быстрее мигрировали вещества на пластине. Оказалась, что при одинаковом угле наклона, скорость на слабо сшитых Сефадексах, таких как G-100 и G-200 «Суперфайн», меньше, чем на Сефадексах с более высокой степенью сшивки, таких как G-50 и G-75 «Суперфайн». Все Сефадексы, используемые в наших исследованиях, по скорости миграции веществ со свободным объемом условно можно разделить на две группы. К первой группе можно отнести Сефадексы G-50 и G-75 «Суперфайн» как имеющие наибольшую скорость миграции, ко второй группе – G-100 и G-200 «Суперфайн» ‒ наименьшую скорость миграции.
При работе на Сефадексе G-200 скорость веществ, мигрирующих со «свободным объемом» (т.е. не проникающих в гранулы геля), не должна превышать 2 см/ч. На гелях Сефадекса с более высокой степенью сшивки скорость может быть несколько больше. Указать заранее оптимальный угол наклона для данного типа геля невозможно, поскольку он зависит от многих факторов, например, от свойств партии геля и консистенции суспензии. Пробег для веществ, мигрирующих со «свободным объемом», должен составлять не менее 15 см. При большем пробеге (до 30–40 см) наблюдается лучшее разрешение и вместе с тем не происходит заметного размывания зон.
В нашей работе при определении молекулярной массы белков кукурузы и пшеницы методом ПГПХ их хроматографировали на сверхтонких Сефадексах G-50, G-100 и G-200. На Сефадексе G-100 альбумины и глобулины кукурузы, экстрагированные 0,2 М раствором хлорида натрия, разделялись на 12 фракций с молекулярной массой от 11000 до 26000.
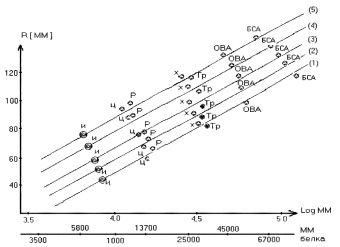
Рис. 1. Зависимость длины пробега R от логарифма ММ стандартных белков на Сефадексе G – 100 «Суперфайн» Время элюирования 3 ч 20 мин. Угол наклона камеры варьировался: 1 – 10°, 2 – 12°, 3 – 15°, 4 – 20°, 5 – 22°
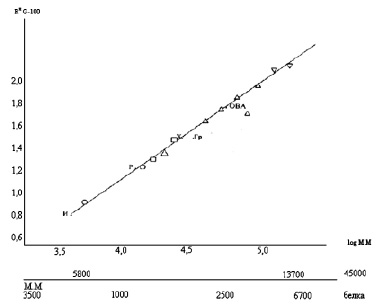
Рис. 2. Зависимость относительной длины пробега Rx G-100 логарифма ММ суммарных белков зерна, муки. (Угол наклона 15°: рн 5,8 элюент фосфатный буфер)  – альбумины 2 фракции
– альбумины 2 фракции  – глобулины 3 фракции
– глобулины 3 фракции  – зеин 5 фракций
– зеин 5 фракций  – глютенины 2 фракции
– глютенины 2 фракции
Проламин кукурузы – зеин дал 5 фракций с молекулярной массой от 32000 до 150500. Глютелин кукурузы разделился на 3 фракции с молекулярной массой 90600 и 120000; альбумины на 2 фракции с молекулярной массой от 5600 до 13500; глютенины ‒ 2 фракции с молекулярной массой от 65000 до 68000. Элюирование проводили в фосфатном буферном растворе (рН = 5,86) при продолжительности разделения 2 часа 30 минут.
Исследование белковых фракций кукурузы с различной растворимостью методом ПГПХ показало, что количество фракций белка зависит не только от молекулярной массы, но и от значения рН среды используемого элюента. Нами была исследована широкая область значений рН 4,0 до рН 10,0.
Выводы
В ранее проведенных исследованиях было обнаружено, что оптимальной зоной рН является слабощелочная среда (рН = 8,0–9,1), в которой проявляется большое количество белковых фракций зерна кукурузы и пшеницы [5].
При смещении значений рН в слабокислую зону наблюдается уменьшение количества определяемых фракций. Можно предположить, что это связано с уменьшением растворимости, особенно водо- и солерастворимых белков вблизи их изоэлектрической точки, находящейся в слабокислой зоне (рН 5,8–4,5) и нейтральной (рН 7,0–6,8) с природой нативных водо- и солерастворимых белков зерна кукурузы, что подтверждают исследования методом градиентной гель-хроматографии на колонке с последующим электрофорезом.
Результаты, полученные при исследовании разделения белковых фракций с разной растворимостью, позволяют утверждать, что рН среды элюента имеет существенное влияние на разрешающую способность метода ПГПХ. Учитывая этот существенный фактор, в разработанной нами методике мы использовали оптимальные значения рН среды элюента при дальнейшем фракционировании водо- и солерастворимых белков.
В качестве маркерного белка применяли трипсин. Калибровочную кривую строили в координатах зависимости относительной длины пробега (замеренной по отношению к длине пробега трипсина) от логарифма молекулярной массы белковой фракции.
По калибровочной кривой, учитывая относительную длину пробега, измеряли длину пробега от стартовой линии – линии нанесения исследуемых объектов до центра окрашенного пятна хроматограммы и выражали в безразмерных единицах по отношению к длине пробега трипсина. Затем находили логарифм ММ образца и определяли его ММ.
Рецензенты:
Алакаева Л.А., д.х.н., профессор кафедры неорганической и физической химии, КБГУ, г. Нальчик;
Борукаев Т.А., д.х.н., профессор кафедры высокомолекулярных соединений химического факультета КБГУ, г. Нальчик.
Работа поступила в редакцию 28.07.2014.
Библиографическая ссылка
Бокова Л.М., Султыгова З.Х., Бокова М.М., Балаева Ф.А., Инаркиева З.И. ОПРЕДЕЛЕНИЕ БЕЛКОВЫХ ФРАКЦИЙ, СОДЕРЖАЩИХСЯ В ЗЕРНОВЫХ КУЛЬТУРАХ И МУКЕ, МЕТОДОМ ГЕЛЬ-ПРОНИКАЮЩЕЙ ХРОМАТОГРАФИИ // Фундаментальные исследования. – 2014. – № 8-6. – С. 1367-1371;URL: https://fundamental-research.ru/ru/article/view?id=34770 (дата обращения: 18.04.2024).



