Перитонит представляет собой комплекс тяжелых патофизиологических реакций с нарушением функционирования всех систем организма. По современным представлениям важная роль в патогенезе перитонита принадлежит нарушениям прооксидантно-антиоксидантного равновесия [1, 11, 12]. Интенсификация прооксидантных процессов, превышающая возможности антиоксидантных систем защиты предотвратить эти процессы, служит основным механизмом развития окислительного стресса. В организме образование оксида азота (NO) осуществляется NO-синтазой (NOS), которая представлена конститутивными изоформами (nNOS, cNOS) и индуцибельной изоформой iNOS. В физиологических условиях образование оксида азота происходит в небольших количествах за счет функционирования конститутивных изоформ, а при воспалительных процессах в организме индуцируется iNOS, что приводит к значительному усилению синтеза оксида азота [15]. В условиях окислительного стресса повышается интенсивность перекисного окисления липидов (ПОЛ), вследствие этого значительная часть оксида азота может расходоваться на реакции с липидными радикалами, что в свою очередь может способствовать обрыванию цепи свободно-радикального окисления липидов [2]. С другой стороны, реакция оксида азота с супероксидным анион-радикалом приводит к усилению образования пероксинитрита, который может вызвать значительные повреждения ДНК, углеводов, белков [25]. Рядом авторов установлено, что неспецифическое ингибирование NOS при эндотоксемии вызывает прогрессирующее повреждение печени, свидетельствующее о том, что образующийся локально при системном воспалении NO играет защитную роль в печени [21]. Другие ученые, изучая роль специфических изоформ iNOS, установили факты прямого гепатотоксического воздействия NO при эндотоксемии [20]. Роль нитроксидергической системы в механизмах регуляции окислительного стресса при экспериментальном перитоните недостаточно изучена.
Целью работы явилось исследование изменений показателей перекисного окисления липидов и антиоксидантной защиты в печени крыс с экспериментальным перитонитом в условиях модуляции L-аргинин-NO системы.
Материалы и методы исследования
Проведены эксперименты с использованием 64 белых половозрелых, неинбредных крыс-самцов массой 220–250 г. Эксперименты проводились в соответствии с требованиями приказов № 1179 МЗ СССР от 10.10.83 г., № 267 МЗ РФ от 19.06.03 г. «Правила проведения работ с использованием экспериментальных животных» и «Правила по обращению, содержанию, обезболиванию и умерщвлению экспериментальных животных». Животные были разделены на 4 группы по 8 крыс в каждой группе. Крысам 1-й группы (ложнооперированные крысы, контроль) внутрибрюшинно вводили стерильный физиологический раствор. У крыс 2, 3, 4 групп моделировали перитонит. Перитонит у животных воспроизводили путем внутрибрюшинного введения 10 % каловой взвеси в дозе 1,0 мл на 100 г массы. Через 8 часов после введения каловой взвеси у всех животных развивались симптомы перитонита: вялость, заторможенность, отказ от пищи, учащенное дыхание, вздутие живота. У крыс 2, 3, 4 групп с целью лечения перитонита через 8 часов после введения каловой взвеси выполняли лапаротомию, оценивали возникшие патологические изменения в брюшной полости и санировали ее. В течение эксперимента все группы животных при остром перитоните получали подкожно физиологический раствор в суточной дозе 40 мл на кг. На животных 2-й группы изучали изменения, происходящие при динамическом развитии перитонита без введения ингибиторов NOS. Модуляцию пути L-аргинин – NO осуществляли путем внутримышечного ежедневного введения ингибиторов NOS в дозе 10 мг/кг с момента моделирования перитонита: неселективного ингибитора NOS – N-nitro-L-Arginine Methyl Ester (L-NAME; «Sigma») у крыс 3-й группы и селективного ингибитора индуцибельной NOS (iNOS) – S-methylisothiourea (S-MT) у крыс 4 группы. Животных выводили из эксперимента на 1-е, 3-е и 5-е сутки после операции. Для обезболивания использовали эфир для наркоза. Выводили животных из опыта путем декапитации. Объектом биохимических исследований служили печень и плазма крови.
Для изучения состояния процессов липопероксидации определяли содержание диеновых коньюгатов [4] и малонового диальдегида, используя метод M. Mihara (1980), заключающийся в образовании окрашенного комплекса при взаимодействии продуктов перекисного окисления липидов (ПОЛ) с тиобарбитуровой кислотой, с помощью стандартного набора фирмы Агат-Мед (Россия). Одновременно с продуктами ПОЛ определяли активность ферментов антиоксидантной защиты: каталазы [5], супероксиддисмутазы [13], а также содержание восстановленного глутатиона, учитывая его способность реагировать с избытком аллоксана с образованием соединения, имеющего максимум поглощения при длине волны 305 нм.
О содержании оксида азота в плазме крови судили по количеству стабильных конечных метаболитов NO, а именно NO2¯ + NO3¯ (UNOX). Принцип метода заключается в одномоментном восстановлении нитратов в нитриты в присутствии VCl3 и реакции диазотирования образовавшимся нитритом сульфаниламида с развитием розовой окраски [9]. Для определения S-нитрозотиолов применили метод, основанный на спектрофотометрическом измерении нитрита в плазме крови до и после добавления Hg(II), которая специфически разрушает S–N связи и катализирует высвобождение из S-нитрозотиолов оксида азота [22]. Для определения генерации супероксиданиона в печени использовали метод, предложенный в работе [3]. Степень повреждения печени оценивали по активности специфического фермента – сывороточной уроканиназы, которая встречается только в печени позвоночных и в норме как в крови, так и в других органах не обнаруживается [7].
Обработку полученных результатов проводили с применением методов вариационной статистики. После проверки нормальности распределения изучаемых параметров в сравниваемых группах тестом Шапиро – Уилка определяли средние величины (М), ошибку средних величин (m). Оценку достоверности проводили по критерию Стьюдента (t). Минимальный уровень статистической значимости различий верифицировали при р < 0,05. Математическую обработку выполняли на компьютере с применением программного обеспечения Microsoft Excel и программы Statistica 6.0.
Результаты исследования и их обсуждение
Исследования проведены в 2 этапа. На первом этапе исследовали активность процессов ПОЛ, систему антиоксидантной защиты печени, суммарное содержание нитритов, нитратов и нитрозотиолов в плазме крови, а также оценивали степень повреждения печени при экспериментальном перитоните. На втором этапе изучали вышеприведенные показатели при применении неселективного ингибитора NOS – N-нитро-L-аргинин метиловый эфир (L-NAME), а также селективного ингибитора индуцибельной NOS – S-метилизотиомочевины. Как следует из данных таблицы, при развитии воспалительного процесса в брюшной полости происходит накопление продуктов ПОЛ в ткани печени, причем проведенная лечебная санация брюшной полости значительно не уменьшила выраженности окислительного стресса.
Влияние модуляции синтеза оксида азота на показатели перекисного окисления липидов, антиоксидантной защиты в печени, содержание стабильных метаболитов оксида азота и S-нитрозотиолов в плазме крови у крыс при перитоните (М ± m)
|
Исследуемый показатель |
Интактные животные (n = 8) |
Группы животных (n = 8 в группе) |
Значение показателей на этапах исследования (от момента моделирования) |
||
|
1-е сутки |
3-е сутки |
5-е сутки |
|||
|
ДК, (λ = 232) усл.ед. на 1 г ткани |
1,9 ± 0,18 |
2-я группа 3-я группа 4-я группа |
3,71 ± 0,15* 3,76 ± 0,19* 3,38 ± 0,16* |
2,95 ± 0,12* 3,23 ± 0,14* 2,83 ± 0,15* |
3,32 ± 0,19* 3,83 ± 0,17*^ 3,08 ± 0,2* |
|
МДА мкмоль на 1 г ткани |
281 ± 14 |
2-я группа 3-я группа 4-я группа |
535,3 ± 23,1* 498,3 ± 20,6* 521,5 ± 16,3* |
449,4 ± 27,8* 481,3 ± 22,4* 464,3 ± 15,9* |
577,7 ± 25,4* 617,5 ± 23,3* 594,7 ± 14,3* |
|
СОД, усл.ед. на 1 мг белка |
41,1 ± 2,5 |
2-я группа 3-я группа 4-я группа |
48,2 ± 2,9 48,9 ± 1,6* 49,9 ± 1,9* |
50,8 ± 2,5* 48,5 ± 1,5* 50,6 ± 2,1* |
31,7 ± 2,6* 24,9 ± 2,0*^ 36,5 ± 3,2* |
|
Каталаза, мМоль в мин на 1 мг белка |
214,8 ± 6,2 |
2-я группа 3-я группа 4-я группа |
181,3 ± 9,6* 185,3 ± 6,2* 187,2 ± 5,5* |
174,5 ± 12,2* 180,8 ± 8,1* 176,2 ± 7,8* |
153,7 ± 5,1* 156,1 ± 5,9* 154,0 ± 5,8* |
|
Восстановленный глютатион, мг % |
149 ± 5,3 |
2-я группа 3-я группа 4-я группа |
133,9 ± 6,2* 118,3 ± 7,8* 141,2 ± 7,5 |
129,1 ± 9,7* 110,0 ± 7,4* 140,3 ± 6,5 |
106,8 ± 7,3* 78,1 ± 7,0*^ 109,8 ± 6,2* |
|
Коэффициент МДА/ДК |
147,9 ± 4,4 |
2-я группа 3-я группа 4-я группа |
144,3 ± 4,1 132,5 ± 5,2 154,3 ± 3,9 |
152,3 ± 5,7 149,0 ± 4,8 164,1 ± 6,8 |
174,0 ± 6,6* 161,2 ± 5,6 193,1 ± 4,7*^ |
|
Содержание UNOX в плазме крови, мкмоль/л |
17,6 ± 0,4 |
2-я группа 3-я группа 4-я группа |
101,8 ± 6,2* 89,2 ± 8,1* 98,5 ± 8,4* |
53,5 ± 4,4* 56,2 ± 5,8* 53,2 ± 5,1* |
64,5 ± 5,9* 53,5 ± 5,0* 68,1 ± 4,7* |
|
Содержание S-нитрозотиолов в плазме крови, нмоль/л |
1015 ± 54,7 |
2-я группа 3-я группа 4-я группа |
3287,3 ± 155,1* 2389,4 ± 120,2*^ 2671,5 ± 95,2*^ |
2028,6 ± 108,5* 1560,6 ± 86,3*^ 1333,7 ± 146,9^ |
3278,8 ± 103,8* 3089,3 ± 121,7* 2278,3 ± 104,8*^ |
Примечания: * – различие достоверно (р < 0,05) по сравнению с интактными животными.
^ – различие достоверно (р < 0,05) по сравнению со 2-й группой на определенные сутки эксперимента.
Содержание диеновых конъюгатов (ДК) гидроперекиси ненасыщенных жирных кислот, являющихся первичными молекулярными продуктами ПОЛ, у крыс второй группы через 24 часа после моделирования патологического процесса увеличивалось на 195,2 % (p < 0,05), а накопление малонового диальдегида (МДА), относящегося к поздним продуктам пероксидации, увеличивалось на 190,5 % (p < 0,05). На 5 сутки эксперимента количество ДК несколько снижается, а содержание МДА возрастает, что находит отражение в увеличении коэффициента МДА/ДК и свидетельствует о нарастающем переходе первичных продуктов ПОЛ в промежуточные и конечные.
Поскольку первичные и вторичные продукты ПОЛ оказывают выраженное повреждающее действие, в организме существуют регуляторные механизмы, ограничивающие накопление высокотоксичных продуктов. Ведущую роль в регуляции ПОЛ играют антиоксидантные ферменты, такие как супероксиддисмутаза (СОД) и каталаза [23]. СОД катализирует реакцию взаимодействия двух супероксидных радикалов с образованием перекиси водорода и молекулярного кислорода, конкурируя с оксидом азота, поскольку скорость реакции NO с супероксиданионом в три раза выше, чем скорость реакции супероксиданиона с СОД [14]. В свою очередь перекись водорода может быть использована фагоцитами для синтеза гипохлорида, обладающего бактерицидным действием, либо диффундировать в клетки и разрушаться там каталазой и глутатионпероксидазой, либо в присутствии Fe+2 разрушаться с образованием гидроксильного радикала. Проведенные исследования установили повышение активности СОД в печени в 1-е и 3-е сутки на 17,3 % (p < 0,05) и 23,6 % (p < 0,05) соответственно, что свидетельствует о мобилизации защитно-приспособительных механизмов, связанных с избыточной продукцией супероксидного аниона-радикала. Избыточная активность СОД ведет к повышенному образованию перекиси водорода. При этом по нашим данным не происходит параллельного увеличения активности каталазы, что может быть связано с повышенной концентрацией водородных ионов, приводящих к возникновению протонированных форм ферментов, обладающих измененной каталитической активностью. В то же время на 5 сутки на фоне сохраняющегося высокого уровня продуктов ПОЛ активность мембраносвязанной СОД, ключевого компонента антиоксидантной защиты, снижалась на 22,9 % (p < 0,05) по сравнению с контролем и на 37,6 % (p < 0,05) по сравнению с данными 3-х суток. Торможение активности СОД во многом связано с избытком перекиси водорода, накапливающейся к 5 суткам вследствие сохраняющегося дефекта каталазы и снижения активности глутатионового звена антиоксидантной защиты. В эти же сроки снижалось и содержание восстановленного глутатиона на 28,3 % (p < 0,05). Глутатион участвует как в индуцированной глутатионпероксидазной реакции, так и в поддержании восстановленного состояния сульфгидрильных групп белковых молекул, редокс-статуса аскорбата и клетки в целом.
При развитии экспериментального перитонита происходило значительное увеличение продукции оксида азота, о чем свидетельствовало более чем 3-кратное повышение содержания суммы его стабильных метаболитов в плазме крови. Разнообразная функциональная активность оксида азота предполагает наличие своеобразных переносчиков, способных потенцировать его биологические эффекты. По современным представлениям, в качестве таких соединений выступают S-нитрозотиолы (RSNO) со структурой R–S–N = 0, в которых NО ковалентно связан с SH-группами белков и низкомолекулярными тиолами, например, глутатионом [17]. Как видно из данных, представленных в таблице, при экспериментальном перитоните значительно изменяется содержание S-нитрозотиолов в плазме крови.
Развивающиеся окислительный и нитролизирующий стрессы являются одним из основных механизмов повреждения печени, что подтверждается ростом активности ее органоспецифического фермента – уроканиназы, с помощью которого можно обнаружить и выявить степень поражения печени (рис. 1). В норме как в крови, так и в других тканях этот фермент не обнаруживается и обнаружение уроканиназной активности у крыс 2-й группы является ранним проявлением патологического процесса в печени.
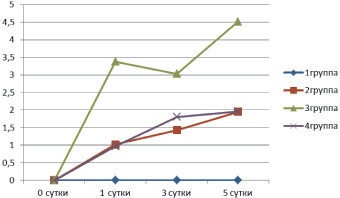
Рис. 1. Влияние модуляции синтеза оксида азота на активность уроканиназы (нмоль/с∙л) в печени у крыс при перитоните (n = 8 в каждой группе)
Активные формы азота и кислорода могут реагировать со многими молекулами-мишенями по разным механизмам и относительное равновесие между этими реакциями является ключевым для определения роли NO в содействии окислительному стрессу, либо в защите от него [19]. В последнее десятилетие оксиду азота (NО) как одному из важных медиаторов различных физиологических и патологических процессов, в том числе и в печени, уделяется пристальное внимание, однако окончательно не установлено, в какие процессы, гепатодеструкции или гепатопротекции, он вовлечен. Учитывая данные обстоятельства, представляло интерес изучение влияния ингибирования образования оксида азота в организме на процессы пероксидации липидов, состояние системы антиоксидантной защиты печени у животных с экспериментальным перитонитом.
У крыс 3-й группы применение L-NAME не оказывало существенного влияния на течение процессов ПОЛ и состояние ферментного звена антиоксидантной системы, однако на 5 сутки перитонита количество ДК и МДА статистически достоверно возрастало на 102 % (p < 0,05) и 119,8 % (p < 0,05) соответственно. Данное обстоятельство можно объяснить существенным снижением активности СОД и содержания восстановленного глутатиона в эти сроки. С целью выявления роли индуцибельной NOS в окислительных процессах при экспериментальном перитоните проведены эксперименты с введением ее ингибитора S-MT животным 4-й группы. Результаты исследования, представленные в таблице, свидетельствуют о незначительном снижении уровня продуктов ПОЛ, без изменения факторов антиоксидантной защиты в сравнении с животными 2-й группы.
Применение блокаторов NO-синтаз – L-NAME и S-MT – привело к незначительному снижению образования NO. Изменения в содержании S-нитрозотиолов были более значительными: у животных на фоне применения L-NAME и S-MT уменьшение концентрации S-нитрозотиолов составило 72,7 % (p < 0,05) и 81,3 % (p < 0,05) соответственно в 1-е сутки эксперимента в сравнении со 2 группой животных. Более выраженное снижение S-нитрозотиолов отражают процессы распада этих соединений, в результате чего повышается содержание в плазме суммы стабильных метаболитов оксида азота, синтез которых блокировался при применении L-NAME и S-MT. Важная роль в этом процессе принадлежит СОД, которая в присутствии восстановленного глутатиона способна катализировать разложение S-нитрозотиолов, индуцируя продолжительную генерацию оксида азота [10]. Вероятно, данным обстоятельством объясняется более выраженное уменьшение концентрации метаболитов оксида азота и более высокое содержание S-нитрозотиолов у животных 3 группы на 5 сутки экспериментального перитонита,
С одной стороны, уменьшение концентрации нитрозотиолов для поддержания уровня оксида азота в крови имеет приспособительное значение, так как оксид азота нейтрализует липидные радикалы, но, с другой стороны, при низком уровне СОД очевидна возможность образования пероксинитрита и токсических проявлений. Образование пероксинитрита в значительной степени зависит от редокс-состояния клетки, которое определяется соотношением восстановленных и окисленных форм соединений: восстановленного (GSH) и окисленного (GSSG) глутатиона; НАДН и НАД+; НАДФН и НАДФ+. Schafer F. и Buettner G. полагают, что редокс-потенциал сопряженных окислительно-восстановительных реакций, протекающих в клетке, в соответствии с уравнением Нернста определяется восстанавливающей способностью субстратов этих редокс-пар и величиной половинного восстановительного потенциала клетки. Половинный восстановительный потенциал клетки в значительной мере зависит от концентрации в ней восстановленного глутатиона [24]. В проведенных исследованиях у крыс 3 группы на 5 сутки экспериментального перитонита отмечается значительное снижение активности СОД на 60,6 % (p < 0,05), а также содержания восстановленного глутатиона на 52,4 % (p < 0,05). Учитывая вышеизложенное, рассматривать пути реализации эффектов NO без учета активности СОД с современных позиций неверно.
Данные, представленные на рис. 1, свидетельствуют об увеличении повреждения печени у животных 3 группы, получавших L-NAME, определяемой по активности уроканиназы, уровень которой к 5-м суткам возрастал в 4,52 раз (p < 0,05). С другой стороны, у крыс 4 группы, получавших S-MT, повреждение печени не увеличивалось в сравнении с животными 2 группы. L-NAME является необратимым ингибитором эндотелиальной NOS и обратимым ингибитором i NOS. Эндотелиальные клетки составляют в печени 12,5 %, а гепатоциты и клетки Купффера составляют вместе 78 % [16], следовательно, вклад эндотелиальных клеток в увеличение продукции оксида азота при экспериментальном перитоните незначительный и в основном увеличение продукции оксида азота связано с iNOS. Данные, представленные в таблице, свидетельствуют, что как при применении L-NAME, так и при S-MT уровень оксида азота в плазме меняется в одинаковой степени, однако у крыс, получавших L-NAME, увеличивается повреждение печени, которое более выражено к 5 суткам. Можно заключить, что блокирование i NOS значительно не изменяет уровень ПОЛ и связанное с ним степень повреждение печени при экспериментальном перитоните. По данным литературы, у крыс усиливалось эндотоксин-индуцированное повреждение печени после применения L-NAME, которое не было связано с увеличением портального давления [26]. Следует, однако, отметить, что авторы измеряли портальное давление, а не печеночную перфузию.
Данные представленные на рис. 2, показывают, что развитие перитонита вызывает незначительное увеличение спонтанной продукции супероксид-анион радикала в гомогенате печени крыс, которое становится более выраженным к 5 суткам эксперимента. Ингибирование продукции NO при применении L-NAME сопровождается повышением спонтанной продукции супероксид-анион радикала на 84,9 % (p < 0,05) по сравнению со 2 группой, а при применении S-MT продукция супероксид-анион радикала увеличивалась в значительно меньшей степени. Следовательно, снижение продукции NO эндотелиальными клетками в условиях применения L-NAME при одновременном повышении уровня супероксиданиона лежит в основе эндотелиальной дисфункции и повреждения в печени у крыс при экспериментальном перитоните.
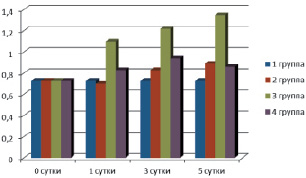
Рис. 2. Влияние модуляции синтеза оксида азота на спонтанную продукцию супероксид-аниона (нмоль/г∙с) в гомогенате печени крыс при перитоните (n = 8 в каждой группе)
В условиях сниженного содержания восстановленного глутатиона и активности СОД изменяется редокс-статус клетки и, вероятно, образуется пероксинитрит, который обладает универсальной биоагрессивностью, может вступать в реакции с нуклеиновыми кислотами, липидами и белками, подавлять митохондриальное дыхание, вызывая тем самым нарушение функции клетки и повреждение тканей [18], что может играть существенную роль в патогенезе повреждения печени как на молекулярном, так и на функциональном уровне. В гепатоцитах глутатионовая система непосредственно обезвреживает активные формы кислорода, либо как вторая линия обороны организма (после микросомальных ферментов и СОД) дополняет и завершает работу первой линии или исправляет ее ошибки [6]. Взаимодействие глутатиона с органическими радикалами эффективно только в условиях удаления супероксидного анион радикала, поэтому глутатион образует с СОД своеобразную антиоксидантную систему.
В серии экспериментов оценили влияние L-NAME и S-MT на выживаемость животных при перитоните. Проведенные исследования свидетельствуют о том, L-NAME оказывает влияние на продолжительность жизни животных с перитонитом. По истечении 5 дней с момента воспроизведения перитонита смертность среди животных 2-й группы и группы животных, получавших S-MT, составила 30 и 20 % соответственно, в то время как в 3-й группе достигла 50 %.
Заключение
Таким образом, комплексный анализ введения селективного и неселективного ингибиторов дает основание считать, что ингибирование индуцибельной NOS не влияет на степень повреждения печени и незначительно увеличивает выживаемость животных при экспериментальном перитоните. Ингибирование продукции NO при применении L-NAME увеличивает генерацию супероксидного анион радикала, что на фоне сниженной активности СОД и содержания восстановленного глутатиона увеличивает вероятность образования пероксинитрита, вызывающего повреждение печени. Увеличение смертности среди крыс, получавших L-NAME, свидетельствует о значении оксида азота, образуемого конститутивной NOS, в защите гепатоцитов от оксидантного повреждения.
Рецензенты:
Миннебаев М.М., д.м.н., профессор кафедры патофизиологии, ГБОУ ВПО «Казанский государственный медицинский университет», г. Казань;
Фролов Б.А., д.м.н., профессор, зав. кафедрой патофизиологии, ГБОУ ВПО «Оренбургская государственная медицинская академия», г. Оренбург.
Работа поступила в редакцию 14.10.2014.
Библиографическая ссылка
Срубилин Д.В., Еникеев Д.А., Мышкин В.А., Исаков И.Д., Исакова А.В., Каширина Е.П. РОЛЬ НИТРОКСИДЕРГИЧЕСКОЙ СИСТЕМЫ В РЕГУЛЯЦИИ ОКИСЛИТЕЛЬНОГО СТРЕССА В ПЕЧЕНИ У КРЫС С ЭКСПЕРИМЕНТАЛЬНЫМ ПЕРИТОНИТОМ // Фундаментальные исследования. – 2014. – № 10-4. – С. 724-731;URL: https://fundamental-research.ru/ru/article/view?id=35612 (дата обращения: 19.04.2024).



