Изучение биологического влияния оксида азота (II) (NO) началось с 80-х годов, когда Роберт Фуршготт и Дж. Завадски выяснили, что расширение кровеносных сосудов под влиянием ацетилхолина происходит только при наличии эпителиоподобных клеток, выстилающих внутреннюю поверхность всех сосудов. Вещество – NO, которое они выделяют в ответ на внешние воздействия, приводит к расширению сосудов, – получило название «сосудорасширяющий эндотелиальный фактор» [6]. Роль NO в поддержании сосудистого гомеостаза: регуляция сосудистого тонуса, пролиферации и апоптоза, оксидантных процессов, NO присущи ангиопротекторные свойства [4]; ответственен за противовоспалительные эффекты, производит фибринолитический эффект [6].
Учитывая важные физиологические функции NO в организме, можно не сомневаться, что в случае заболевания этот радикал будет вовлечен в развитие многих патологических реакций. В настоящее время активно изучают следующие группы заболеваний, для развития которых характерны изменения в обмене NO: болезни сердечно-сосудистой системы, в том числе гипертонию, инфаркт миокарда, легочную гипертензию, атеросклероз; инсульты и поздние дегенеративные заболевания нервной системы; различные аутоиммунные заболевания, диабет, отторжение трансплантатов; процессы острого и хронического воспаления различных органов и тканей, особенно эндотоксемию, отек, шок; цирроз печени, болезнь почек, легких, ЖКТ; онкологические заболевания [6].
Аргинин – условно незаменимая аминокислота, которая является субстратом для синтеза NO [9]. При низких концентрациях в плазме крови L-аргинин избирательно улучшает эндотелиальную функцию; при среднем уровне концентрации может оказывать прямую вазодилатацию вследствие стимуляции секреции инсулина и гормона роста; высокие уровни L-аргинина вызывают неспецифическую вазодилатацию [1]. Перспективность использования L-аргинина как полузаменимой аминокислоты в терапии ряда патологий известна давно [2, 4]. Однако в какой степени достигаемые эффекты (снижение артериального давления, коррекция эндотелиальной дисфункции при гиперхолестеринемии, терапия гломерулонефрита) опосредуются через NO, остается пока невыясненным.
Смерть клетки является одной из центральных проблем биологии и медицины, она может происходить двумя путями: путем апоптоза и в результате воздействия внешних факторов. Имеется значительное число научных публикаций, убедительно свидетельствующих об эффективном защитном действии NO против клеточного апоптоза. В настоящее время хорошо известно, что важным и значимым в диагностике показателем апоптоза (через активацию каспаз) является степень активации лизосомальных цистеиновых протеиназ. Экспрессию катепсинов часто связывают с развитием апоптоза [3]. Будучи секретированными или связанными с плазматической мембраной, катепсины способны разрушать белковые компоненты мембран и внеклеточного матрикса. Активация лизосомальных протеаз свидетельствует об иммунном ответе организма, их контроль позволит избежать патологических повреждений клеток и тканей [10].
Цель – определение изменения секреции лизосомальных цистеиновых протеиназ в миокарде и скелетной мышце крысы на фоне введения L-аргинина и в группе контроля.
Материалы и методы исследования
Работа выполнена на 12 конвенциональных половозрелых крысах-самцах линии Wistar массой 280–320 граммов. Моделирование изменения уровня синтеза оксида азота (II) субстратом NO-синтазы в экспериментальной группе (n = 6) осуществляли путем внутрижелудочного введения раствора L-аргинина («Sigma», США) на 0,9 % растворе NaCl в дозе 500 мг/кг [5] через стеклянный градуированный шприц с внутрижелудочным зондом. Объем вводимого раствора зависел от массы и не превышал 1 мл. Препарат вводили 1 раз в сутки до утреннего кормления ежедневно в течение 10 дней. Контрольной группе параллельно (n = 6) внутрижелудочно вводили физиологический раствор.
Содержание и выведение животных из эксперимента выполняли в соответствии с правилами, изложенными в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985) и приказе МЗ РФ № 267 от 19.06.2003 г. «Об утверждении правил лабораторной практики».
Активность кислых гидролаз в седиментируемой (СА) и неседиментируемой (НСА) фракциях определяли раздельно. Общую активность (ОА) рассчитывали как сумму СА и НСА. Коэффициент лабильности (К лаб, %) – это процентное отношение НСА к ОА, характеризует проницаемость лизосомальной мембраны для изучаемого фермента.
Активность катепсинов В, L и Н (КВ, КL, KH) изучалась спектрофлуориметрическим методом по Barrett & Kirschke [9].
Метод оценки степени секреции лизосомальных цистеиновых протеаз основан на одновременной оценке двух параметров – коэффициент лабильности катепсина и коэффициент лабильности кислой фосфатазы как показателей функционального состояния лизосомальной мембраны. Затем рассчитывается безразмерный биохимический показатель – доля секретируемой активности лизосомальных цистеиновых протеаз – коэффициент Wsecr: возрастание (положительное значение) данного показателя говорит о секреции катепсинов за счет проницаемости мембраны, а уменьшение (отрицательное значение) свидетельствует о нарушении целостности лизосомальной мембраны [7].
Степень аутокаталитического действия катепсинов оценивалась по коэффициенту отношения значения активности фермента после прекаталитической инкубации к параллельно определяемому значению активности без преинкубации (Kaca – коэффициент аутокаталитического действия).
Статистический анализ результатов исследования проведен с использованием программы «Statistica 10.0». Поскольку отмечалось отсутствие согласия большинства данных с нормальным распределением, вычисляли характеристики: медиану (Ме), минимальное (min) и максимальное (max) значения, результаты представлены в формате Ме [min; max], для оценки статистической значимости различий независимых выборок использовали ранговый критерий Манна – Уитни (U-тест).
Результаты исследования и их обсуждение
При оценке изменений активности изучаемых ферментов (табл. 1) обнаружено, что влияние L-аргинина не приводит к статистически значимым изменениям изучаемых показателей, за исключением статистически значимого снижения активности катепсина В в цитоплазматической (неседиментируемой) фракции.
В то же время в скелетной мускулатуре практически все изменения активности катепсинов оказались статистически значимыми. Так, общая активность катепсинов В и Н в скелетной мышце под влиянием L-аргинина нарастала, при этом изменения касались как лизосомальной (седиментируемой), так и цитоплазматической (неседиментируемой) фракций. При этом изменения активности катепсина L оказались противонаправленными: выраженное снижение общей и неседиментируемой активности с умеренным снижением седиментируемой активности.
Таблица 1
Влияние L-аргинина на показатели активности лизосомальных цистеиновых протеиназ в сердечной и скелетной мышцах (нмоль/с х г белка), Ме [min; max]
|
Ткань |
Миокард |
Скелетная мускулатура |
|||
|
Показатель |
Контроль |
L-аргинин |
Контроль |
L-аргинин |
|
|
КВ |
НСА |
1,08 [0,25; 3,9] |
0,15* [0,12; 0,31] |
0,45 [0,07; 0,92] |
1,53* [0,60; 3,05] |
|
СА |
0,96 [0,24; 4,64] |
1,28 [1,05; 3,06] |
0,21 [0,05; 0,70] |
1,30* [0,57; 2,97] |
|
|
ОА |
2,00 [0,58; 10,32] |
1,54 [1,17; 3,19] |
0,72 [0,12; 1,51] |
3,00* [1,16; 6,02] |
|
|
КL |
НСА |
0,41 [0,26; 0,82] |
0,57 [0,35; 0,90] |
0,64 [0,48; 0,85] |
0,28* [0,27; 0,49] |
|
СА |
6,42 [1,68; 7,67] |
5,02 [2,11; 7,46] |
5,53 [3,89; 11,21] |
3,62 [2,81; 4,59] |
|
|
ОА |
6,84 [1,94; 8,47] |
5,37 [2,62; 8,03] |
6,17 [4,37; 12,06] |
3,90* [3,18; 5,08] |
|
|
КН |
НСА |
0,32 [0,18; 0,51] |
0,41 [0,39; 0,49] |
0,26 [0,23; 0,28] |
0,57* [0,5; 0,63] |
|
СА |
2,25 [1,71; 3,48] |
3,12 [2,14; 3,89] |
3,23 [1,44; 4,74] |
5,23* [4,92; 8,01] |
|
|
ОА |
2,57 [1,89; 3,99] |
3,5 [2,54; 4,38] |
3,48 [1,69; 5,02] |
5,73* [5,45; 8,64] |
|
Примечание. * – статистически значимые отличия от группы контроля (р < 0,05).
Оценка показателей проницаемости лизосомальной мембраны (табл. 2) демонстрирует статистически значимое снижение Клаб, % для катепсина В в сердечной и скелетной мышцах по сравнению с группами контроля. Так, обнаружено, что данный фермент демонстрирует высокие показатели коэффициента лабильности лизосомальной мембраны в контрольной группе; эффект L-аргинина проявляется выраженным статистически значимым снижением этого параметра. Известно, что доля внелизосомальной активности и коэффициент лабильности лизосомальной мембраны для каждого из катепсинов может изменяться по двум причинам: изменение общей проницаемости лизосомальной мембраны и изменение степени секреции индивидуального фермента.
Таблица 2
Влияние L-аргинина на показатели коэффициентов лабильности и доли внелизосомальной активности лизосомальных цистеиновых протеиназ в мышечных тканях, Ме [min; max]
|
Ткань |
Миокард |
Скелетная мускулатура |
|||
|
Показатель |
Контроль |
L-аргинин |
Контроль |
L-аргинин |
|
|
КВ |
Клаб, % |
54,7 [39,8; 59,1] |
10,5 * [3,98; 17,1] |
62,2 [53,9; 71,1] |
50,7* [46,4; 56,7] |
|
Wsecr |
0,73 [0,62; 0,87] |
–0,8* [–2,73; 0,04] |
0,87 [0,82; 0,93] |
0,77* [0,71; 0,79] |
|
|
КL |
К лаб, % |
8,1 [5,4; 13,6] |
12,8 [6,4; 19,6] |
10,4 [7; 11,2] |
8,4 [6,2; 11,6] |
|
Wsecr |
–0,62 [–1,78; 0,26] |
–1,09 [–1,77; 0,24] |
0,21 [0,05; 0,39] |
–0,41* [–1,02; –0,06] |
|
|
КН |
Клаб, % |
11,2 [9,5; 14,99] |
11,3 [11; 15,9] |
7,2 [5,5; 15,2] |
8,7 [7,3; 10,7] |
|
Wsecr |
–0,24 [–0,59; 0,44] |
–0,62 [–0,67; –0,27] |
0,04 [–0,17; 0,34] |
–0,39* [–0,58; –0,21] |
|
Примечание. * – статистически значимые отличия от группы контроля (р < 0,05).
Сочетание анализа изменений коэффициента лабильности лизосомальной мембраны с Wsecr (табл. 2) позволяет предполагать, что причиной выявленных сдвигов в сердечной и скелетной мышцах является уменьшение степени секреции катепсина В (статистически значимые снижения Wsecr в изучаемых органах) через неповрежденную мембрану, которая обладает дифференциальной проницаемостью для всех лизосомальных цистеиновых протеиназ. В случае с катепсинами L и Н в миокарде статистически значимых данных Клаб, % и Wsecr не обнаружено.
Заключение о подавлении секреции катепсинов L и Н скелетной мускулатуры в данной экспериментальной модели с нарушением целостности лизосомальной мембраны позволяют сделать статистически значимое снижение показателя Wsecr на фоне малых изменений показателей коэффициентов лабильности этих ферментов.
Миокард демонстрирует статистически значимое нарастание показателей Каса (рисунок) под действием L-аргинина для катепсина В в обеих субклеточных фракциях: НСА: 0,71 [0,34; 1,11] – 5,55 [1,7; 6,34]; CA 0,83 [0,31; 1,78] – 1,13 [0,59; 1,7] контрольная и опытная проба соответственно, следует заметить, что значительное увеличение НСА у исследуемых коэффициентов говорит о высокой степени аутопроцессинга данного фермента. Изменения коэффициентов для катепсинов L и Н в сердечной мышце оказались статистически не значимыми, однако катепсин Н повторяет изменения катепсина В, которые протекают не так ярко, что может говорить об аутокаталитической активации с созданием активных форм из проферментов.
В скелетной мышце, напротив, у катепсина В отмечается статистически значимое резкое снижение показателей Каса по сравнению с данными контрольной группой крыс в неседиментируемой и в седиментируемой фракциях: НСА 2,66 [0,54; 8,92] – 0,54 [0,11; 1,22]; CA 1,54 [0,11; 6,88] – 0,61 [0,35; 1,12] контрольная и опытная проба соответственно, что может быть результатом аутокаталитического расщепления или связыванием с растворимыми формами ингибиторов в процессе преинкубации в лизосомах и цитоплазме.
В то же время для катепсина L в данной ткани получено статистически значимое нарастание коэффициентов в седиментируемой (лизосомальной) фракции 0,09 [0,02; 0,38] – 1,16 [0,92; 1,52] контрольная и опытная проба соответственно, изменения наблюдаются при нарастании проферментных форм, что является фактором запуска аутокаталитического процессинга.
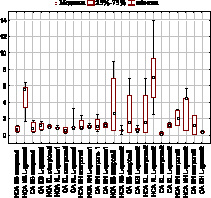
Диаграмма размаха коэффициента аутокаталитического действия миокарда (1) и скелетной мускулатуры (2)
Таким образом, введение субстрата синтеза NO L-аргинина приводит к изменению содержания в мышечных тканях проферментных и активных форм лизосомальных цистеиновых катепсинов; наибольшей чувствительностью при этом обладает катепсин В.
Выводы
1. L-аргинин в дозе 500 мг/кг вызывает нарастание активности катепсинов В и Н в скелетной мускулатуре с одновременным снижением активности катепсина L.
2. Введение L-аргинина приводит к снижению секреции всех изучаемых катепсинов в мышечной ткани и катепсина В в миокарде.
3. L-аргинин вызывает нарастание количества проферментных форм катепсина В в миокарде с параллельным снижением их содержания в скелетной мышце.
Рецензенты:Емельянова А.С., д.б.н., профессор кафедры технологии производства и переработки продукции животноводства, ФГБОУ ВПО «Рязанский государственный агротехнологический университет имени П.А. Костычева», г. Рязань;
Демихов В.Г., д.м.н., профессор, директор Рязанского филиала, ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Д. Рогачёва», г. Рязань.
Работа поступила в редакцию 10.12.2014.
Библиографическая ссылка
Арапова А.И., Фомина М.А. ЭФФЕКТЫ L-АРГИНИНА НА СОСТОЯНИЕ ЛИЗОСОМАЛЬНОГО ЦИСТЕИНОВОГО ПРОТЕОЛИЗА СЕРДЕЧНОЙ И СКЕЛЕТНОЙ МЫШЦ // Фундаментальные исследования. – 2014. – № 10-7. – С. 1269-1273;URL: https://fundamental-research.ru/ru/article/view?id=36102 (дата обращения: 16.04.2024).



