В настоящее время основными показателями действия инфузионно-трансфузионных сред являются молекулярная масса, концентрация, осмотическая, коллоидно-онкотическая активность и активность молекул среды. Обычно все эти показатели учитываются при проведении инфузионно-трансфузионной терапии при интенсивной терапии. Однако эффективность жидких сред зависит не только от этих показателей, но и от активного движения молекул в применяемых растворах. Методы, оценивающие активное движение молекул в инфузионно-трансфузионных растворах, в медицинской практике практически не используются. На уровне развития современной физики об активности молекул среды можно судить, наблюдая вращение введенных в нее молекул красителей, которое зависит от движения собственно молекул, их концентрации в субстрате и резонансного переноса энергии [2, 3]. В последнее десятилетие для исследования данных процессов активно используются методы интеграции флуоресцентной спектроскопии в световой микроскопии с молекулами красителей различной молекулярной массы [4, 5]. Измеряемый параметр – время релаксации анизотропии (ВРА) люминесценции молекул красителя. В медицинской практике применяются растворы, в состав которых входят вещества самой различной молекулярной массы и ионного состава, как и любых биологических жидкостей, таких как плазма, ликвор, моча и др. [1]. Большинство из активных субстратов в этих биологических жидкостях относятся к веществам со средним молекулярным весом. Именно поэтому для оценки времени релаксации анизотропии люминесценции нами был использован родамин 6G с молекулярной массой 479,02 г/моль.
Цель исследования – изучить время релаксации анизотропии родамина 6G в инфузионно-трансфузионных средах, применяемых в медицинской практике и провести сравнительный анализ этого показателя с традиционными характеристиками различных жидких медицинских сред.
Материалы и методы исследования
В качестве пробных частиц нами использованы молекулы родамина 6G с молекулярной массой 479,02 г/моль, позволяющие оценить влияние молекул аналогичной массы на вращение красителя, после введения которого наблюдали люминесценцию данного препарата. Проведя анализ литературы и характеристик растворов, применяемых в общемедицинской практике, было решено использовать краситель данной молекулярной массы, так как он примерно соответствует молекулярной массе изучаемых растворов.
Измерение было проведено в 14 различных растворах: вода очищенная, NaCl 0,9 %, альбумин 10 %, глюкоза 5 %, ацесоль, волювен 6 %, рингер, лидокаин 2 %, маннитол 15 %, гиперХАЕС 6 %, полиглюкин 6 %, гелофузин 4 %, реополиглюкин 10 %, формалин 10 %. Также были систематизированы и учтены их основные физико-химические показатели, учитываемые в общемедицинской практике. Также проведено измерение в растворах альбумина различных концентраций.
Результаты исследования и их обсуждение
Родамин 6G – C28H31N2O3Cl. Молярная масса – 479,02 г/моль. Краситель имеет яркую люминесценцию при 550 нм (максимум при 568 нм) с квантовым выходом, близким к единице. Поглощение происходит в двух полосах: при 470 и 530 нм.
Для проведения исследования в объём растворов, равный 0,1 мл, вводилось 0,5 мкл приготовленного заранее водного раствора родамина. Концентрация красителя в исходном растворе, одинаковая во всех измерениях, не изменялась и была подобрана экспериментально так, чтобы краситель давал яркую люминесценцию, однако коллективные процессы ещё не начинались. Образцы от момента забора и до анализа хранились в холодильнике при температуре 2–5 °C. Помещение для исследований было термостабилизировано при температуре 24 °C. После разведения, образец растворов с введённым в него красителем помещался на покровное стекло, после чего в течение пяти минут записывалась одна из поляризационных компонент люминесценции. После замены образца записывалась вторая компонента. Общее время одного исследования составляло около 10 минут, со скоростью регистрации около 40000 фотонов в секунду. Для устранения влияния посторонней засветки помещение, где выполнялось исследование, было затемнено.
Исследование образцов было проведено на лазерном конфокальном люминесцентном микроскопе MicroTime 200, PicoQuantGmbH. Применялся лазер, работающий на длине волны 470 нм с временным разрешением 8 пс с частотой импульсов 10 МГц. В отличие от традиционного понятия «вязкости жидкости», понимаемой как свойство текучих тел оказывать сопротивление перемещению одной их части относительно другой и определяемой с помощью классических методов, изменение вязкости жидкой среды можно зафиксировать, наблюдая броуновское движение введенных в нее пробных частиц. Частицы в растворе вследствие соударения с частицами среды постоянно изменяют скорость и хаотично вращаются. Скорость броуновского вращения частицы в среде в рамках гидродинамического приближения Эйнштейна – Дебая – Стокса определяется коэффициентом диффузии по формуле (1)
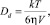
где Dd – коэффициент вращательной диффузии; T – абсолютная температура; η – вязкость раствора; V – объем частицы; k – постоянная Больцмана.
В эксперименте измеряются поляризованные компоненты интенсивности люминесценции. Параметром, характеризующим поляризацию люминесценции, является анизотропия (2):
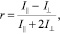
где I║ – интенсивность поляризационной компоненты, поляризованной в той же плоскости, что и возбуждающий свет, а I┴ – в ортогональной к ней.
Применялся лазер, работающий на длине волны 470 нм с временным разрешением 8 пикосекунд (пс) с частотой импульсов 10 МГц. Возбуждение представлено лазером LDH-P-C-470B, работающим на частоте 10 МГц, имеющего длину волны около 470 нм, длительность импульса от 73 пс, развивающего максимальную мощность до 0,8 мВт. Люминесценция собирается в диапазоне от 500 нм, размер пинхола в конфокальной схеме 50 нм, длительность эксперимента 5 мин×2 измерения (вертикальная и горизонтальная поляризованные компоненты, измеряются отдельно).
Люминесценция образца возбуждается лазером, затем, через объектив, лазерный луч попадает на пинхол (фотографическая камера без линз, где в качестве объектива используется небольшое отверстие (англ. pinhole — булавочное отверстие)), который устанавливается в фокусе цилиндрической линзы и обрезает все лучи, идущие не из фокуса объектива, что обеспечивает высокое пространственное разрешение. Далее луч проходит через сеть фильтров. Регистрация осуществляется лавинным фотодиодом (электронная лавина: выбитый фотоном электрон выбивает несколько, тем самым усиливая фототок), работающем в режиме время коррелированного счета одиночных фотонов. Для каждого фотона измеряется время между вспышкой лазера и событием регистрации с точностью 8 пс. Далее устройством PicoHarp 300, PicoQuant GmhH данные передаются для анализа на компьютер.
Первоначально были проведены эксперименты с очищенной водой (в 1 мл воды разводили 5 мкл раствора родамина). Полученное для воды значение времени релаксации анизотропии, составившее 305 пс, в дальнейшем использовано как опорная точка при рассмотрении остальных значений. На рис. 1 показаны кривые изменения поляризационных компонент люминесценции молекул родамина 6G в очищенной воде. Время на графике отсчитывается в абсолютных координатах, с момента вспышки лазера. Разная форма кривых на графиках обусловлена тем, что параллельная компонента возбуждается непосредственно, в то время как перпендикулярная компонента – за счёт поворота возбуждённых молекул из исходного положения.
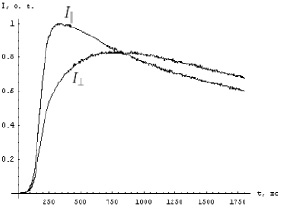
Рис. 1. Кривые затухания параллельной и перпендикулярной компонент люминесценции молекул родамина 6Ж в очищенной воде
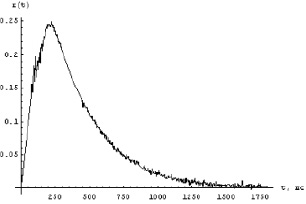
Рис. 2. Кривая затухания анизотропии люминесценции в очищенной воде
|
№ п/п |
Раствор |
ВРА (пс) |
Осмолярность (мосмоль/л) по данным РЛС |
Молекулярный вес (килодальтон |
Состав (на 1 литр) |
|
1 |
Вода очищенная |
305 |
1 |
0,018 |
– |
|
2 |
NaCl 0,9 % |
309 |
308 |
0,06 |
NaCl – 9 г |
|
3 |
Ацесоль |
318 |
294 |
0,215 |
Натрия ацетат – 2 г; NaCl – 5 г; KCl – 1 г |
|
4 |
Рингер |
319 |
309 |
0,208 |
NaCl – 8,6 г; CaCl – 0,33 г; KCl – 0,3 г |
|
5 |
Глюкоза 5 % |
352 |
277 |
30–40 |
Глюкоза обезвоженная – 50 г (Глюкозы моногидрат – 55 г) |
|
6 |
Лидокаин 2 % |
355 |
310 |
234 |
Лидокаина хлорид – 20 г; натрия хлорид – 6 г |
|
7 |
Формалин 10 % |
374 |
3030 |
0,03 |
Формальдегид – 100 г |
|
8 |
Реополиглюкин 10 % |
437–436 |
316 |
30–40 |
Декстран – 100 г; глюкоза – 50 г; NaCl – 9 г |
|
9 |
Маннитол 15 % |
457 |
1131 |
182 |
Маннитол – 150 г; NaCl – 9 г |
|
10 |
Волювен 6 % |
490 |
308 |
130 |
Поли(0-2-гидроксиэтил) крахмал – 60 г; NaCl – 9 г |
|
11 |
Гелофузин 4 % |
516–518 |
274 |
23,2 |
Сукцинилированный желатин – 40 г; NaCl – 7 г; NaOH – 1,36 г |
|
12 |
Полиглюкин 6 % |
558–581 |
308 |
50–70 |
Декстран – 60 г; NaCl – 9 г |
|
13 |
Альбумин 10 % |
582 |
232 |
60–69 |
Белки плазмы крови человека – 100 г; натрия каприлат – 3 г |
|
14 |
ГиперХАЕС 6 % |
595 |
2464 |
200 |
Гидроксиэтилкрахмал – 60 г; NaCl – 72 г |
Примечание. РЛС – реестр лекарственных средств России.
На рис. 2 приведена кривая изменения анизотропии люминесценции. Время на графике отсчитывалось с момента начала спадания верхней кривой.
Были получены результаты исследования растворов жидкости. Основные характеристики исследованных растворов приведены в таблице.
Обращают на себя внимание крайние значения показателя ВРА у воды очищенной и гиперХАЕСа. Разница в изучаемом показателе составила 290 пс, в то же время показатели осмолярности и молекулярного веса различаются на значения 2463 мосмоль/л и 199,9 килодальтон соответственно. Если рассчитать процентное соотношение, то ВРА воды очищенной составляет 51,2 % от ВРА гиперХАЕСа, в то время как осмолярность и молекулярный вес находятся в значениях 0,04 и 0,009 % от аналогичных у гиперХАЕСа. Следовательно, ни один, ни второй показатель не отражают истинной зависимости времени релаксации анизотропии от своих величин.
Также стоит обратить внимание на растворы с максимальным показателем времени релаксации анизотропии (гиперХАЕС – 595 пс и 10 % альбумин – 582 пс), у которых разница в молекулярном весе составила 135 килодальтон. Резонно предположить, что если бы время релаксации анизотропии зависело от молекулярного веса, то показатель времени релаксации анизотропии у альбумина должен был быть гораздо ниже.
Ярко выражена разница показателей у раствора гиперХАЕС (время релаксации анизотропии – 595 пс, осмолярность – 2464 мосмоль/л) и раствора формалина 10 % (время релаксации анизотропии – 374 пс, осмолярность 3030 мосмоль/л). Напрашивается предположение, что при прямой зависимости времени релаксации анизотропии от осмолярности показатель ВРА 10 % формалина должен быть выше, нежели аналогичный у гиперХАЕСа, однако на деле он меньше на 221 пс.
Дополнительно были приготовлены растворы альбумина различной концентрации и проведены измерения времени релаксации анизотропии в них. На рис. 3 представлен графический результат, полученный при исследовании образца.
Время релаксации анизотропии раствора 1 % альбумина составило 383 пс, 2,5 % альбумина – 406 пс, 5 % альбумина – 455 пс Также стоит учесть результат измерения времени релаксации анизотропии у официнального 10 % раствора альбумина, применяемого в медицинской практике, равный 582 пс.
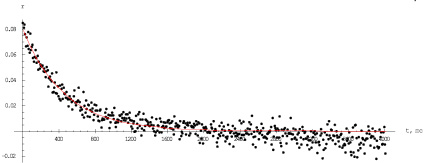
Рис. 3. ВРА 5 % раствора альбумина
При увеличении концентрации растворов с 1 до 5 % наблюдалось увеличение значения времени релаксации анизотропии, что позволяло предположить зависимость данного показателя от концентрации раствора. Также стоит отметить, что у официнального раствора 10 % альбумина время релаксации анизотропии имеет свое наивысшее значение по сравнению с другими разведениями. Перед нами предстает практически геометрическая зависимость времени релаксации анизотропии от концентрации раствора.
Заключение
Исходя из приведенных данных, можно утверждать, что время релаксации анизотропии зависит и от молекулярного веса раствора и соответственно его осмолярности, выполненных в стандартных физико-химических условиях, и, как следствие, является самостоятельным показателем, ранее не используемым в медицинской практике.
Полученные результаты говорят о целесообразности продолжения исследований в данном направлении, так как вполне вероятно, что величина этого показателя в применяемых растворах как зависит, так и влияет на водно-электролитный обмен, кислотно-щелочное состояние организма, гемодинамические показатели пациентов, реологические свойства крови, скорость и продолжительность действия препарата, ответные реакции организма на вводимый раствор.
Можно считать, что использование метода конфокальной лазерной спектрометрии при оценке ВРА заслуживает дальнейшего развития и после дополнительных исследований может рассматриваться как объективный метод оценки активности инфузионно-трансфузионных сред, особенно при проведении интенсивной терапии.
Рецензенты:Надирадзе З.З., д.м.н., профессор, главный анестезиолог-реаниматолог Иркутской области, заведующий отделением анестезиологии и реанимации № 2, ГБУЗ «Иркутская областная клиническая больница», г. Иркутск;
Апарцин К.А., д.м.н., профессор, заместитель директора по научной и лечебной работе, заведующий лабораторией клинических исследований, руководитель отдела медико-биологических исследований и технологий, Научный центр реконструктивной и восстановительной хирургии Сибирского отделения РАН Иркутского научного центра Сибирского отделения РАН, г. Иркутск.
Библиографическая ссылка
Горбачев В.И., Горбачев С.В., Бартуль А.В., Зилов С.А., Лохов А.В. ВРЕМЯ РЕЛАКСАЦИИ АНИЗОТРОПИИ КАК МЕТОД ОЦЕНКИ ФИЗИКО-ХИМИЧЕСКОЙ АКТИВНОСТИ ЛЕКАРСТВЕННЫХ ИНФУЗИОННО-ТРАНСФУЗИОННЫХ СРЕД // Фундаментальные исследования. – 2015. – № 1-9. – С. 1801-1805;URL: https://fundamental-research.ru/ru/article/view?id=38429 (дата обращения: 19.04.2024).



