Производные фенолов – наиболее распространенные загрязнения, поступающие в поверхностные воды со стоками предприятий нефтеперерабатывающей, сланцеперерабатывающей, лесохимической, коксохимической, целлюлозно-бумажной промышленности и др. Фенол и его гомологи являются трудно деструктирующимися соединениями, ингибирующими биосинтез микроорганизмов, что значительно затрудняет самоочистку водных объектов. Так, минимальные токсические дозы, уменьшающие на 50 % количество микроорганизмов, обеспечивающих обезвреживание опасных соединений в воде, для фенола, гидрохинона и катехина составляют всего лишь 22,1; 0,08; 31,8 мг/л соответственно. Таким образом, попадание в водоем даже незначительного количества фенольных соединений приводит к уменьшению способности водного объекта к саморегенерации с помощью имеющегося геобиоценоза и невозможности в дальнейшем дезактивации других загрязнений. Кроме того, фенол и его производные обладают высокой токсичностью для человека и относятся к высоко опасным веществам 2-го класса опасности. Предельно допустимая концентрация фенола в воде хозяйственно-питьевых и рыбохозяйственных объектов лимитирована до 0,001 мг/л [3].
Преимущество использования биологических методов деструкции объясняется тем, что микроорганизмы обезвреживают фенольные вещества, не оказывая отрицательного влияния на экосистему, и не вызывают появления новых загрязняющих агентов в окружающей среде. Деструктивные методы пригодны для вод с концентрацией фенолов до 1 г/л.
Способность видов рода Trichoderma утилизировать широкий набор углеродных субстратов, технологичность, сравнительно высокая скорость роста и низкая токсичность в отношении растений и животных предполагают возможность их использования, наряду с традиционными для этого рода отраслями биотехнологии, для биодеструкции фенольных соединений. Во многих работах было показано, что грибы рода Trichoderma могут быть весьма устойчивы к промышленным загрязнениям окружающей среды.
Целью работы был подбор активных штаммов рода Trichoderma для биологической деструкции фенола при поверхностном и глубинном культивировании.
Материалы и методы исследования
Для проведения исследований были отобраны 6 моноспоровых штаммов различных видов грибов рода Trichoderma, выделенных из почв различных лесорастительных зон Средней Сибири и Республики Тыва и обладающих стабильными культурально-морфологическими признаками: Trichoderma asperellum «Mg-6», Trichoderma asperellum «TH-11», Trichoderma harzianum «M99/5», Trichoderma koningii «ТСЛ-06», Trichoderma koningii «ТСГ», Trichoderma viride «Lg-1».
Фенолоксидазная активность штаммов рода Trichoderma определялась реакцией Бавендамма, широко используемой для быстрого отбора грибов с высокой активностью внеклеточной фенолоксидазы. Метод Бавендамма разработан для выявления оксидазной активности у дереворазрушающих базидиомицетов, однако используется и для дейтеромицетов, в том числе Trichoderma. Цветной реакцией Бавендамма обнаруживают не менее трех ферментов: п-дифенолоксидазу (лакказу), пероксидазу и 0-дифенолоксидазу (тирозиназу). В качестве субстрата был использован таннин, так как для дейтеромицетов из всех субстратов он признан универсальным [5]. Таннин добавлялся к агаризованной среде Чапека в количестве 0,2 %.
Для анализа изучаемые штаммы высевали на питательную среду Чапека следующего состава, г: глюкоза – 30,0; NaNO3 – 2,0; MgSO4 – 0,5; КCl – 0,5; K2HPO4 – 1,0; FeSO4 – 0,01; агар – 20,0, вода дистиллированная – 1000 мл с добавлением таннинов (0,1 г/л) вместо азотсодержащего соединения. Среду автоклавировали при 0,5 атм. в течение 30 минут, разливали в чашки Петри и засевали исследуемыми штаммами методом укола. Культивирование осуществляли в термостате при 25–27 °С в течение 9 суток. О выделении фенолоксидаз судили на основании появления пигмента в среде в процессе роста гриба. Тест считали положительным, если появлялась окрашенная зона агара под старым, молодым мицелием или за пределами роста колонии.
Для оценки способности роста штаммов Trichoderma в присутствии различных концентраций фенола, как единственного источника углеродного питания, использовали поверхностное и глубинное культивирование.
При поверхностном методе культура растет на поверхности твердой увлажненной питательной среды в виде мицелиальной пленки, которая субстратным мицелием всасывает ингредиенты питательной среды, а воздушным мицелием формирует репродуктивные органы. Этот способ культивирования обеспечивает полный цикл развития гриба, но является более медленным процессом из-за интрагифального транспорта питательных веществ от субстратного мицелия к растущим терминальным клеткам воздушного мицелия [6]. Фенол добавляли в среду Чапека вместо глюкозы в концентрациях 20; 50; 70 мг/л. Споры гриба наносили уколом в среду петлей в центр чашки Петри. Результаты снимали на 7 сутки.
Глубинный метод культивирования заключается в выращивании микроорганизмов в жидкой питательной среде при периодическом перемешивании. Этот способ обеспечивает возможность интенсивного роста мицелия, накопление продуктов обмена и высокий уровень механизации процесса, но не обеспечивает полного цикла развития мицелиальным грибам, и стадия спороношения в этих условиях у фенотипа слабо выражена или совсем не осуществляется [7]. Для этого использовали питательную среду Чапека, без добавления агара, содержащую в качестве источника углерода фенол в концентрациях 20; 50; 70 мг/л. Результаты исследований снимали на 14 сутки.
Определение концентрации фенола после культивирования проводили фотометрическим методом [2]. Метод основан на образовании оранжево-желтого комплекса фенола с пара-нитроанилином в щелочной среде.
Аликвотную часть анализируемой сточной воды объемом, не превышающим 5 мл, переносили в колбу вместимостью 25 мл, добавляли 1 мл диазотированного раствора пара-нитроанилина и доводили до метки поглотительным раствором (натрий углекислый, раствор 8 г/л). Диазотированный пара-нитроанилин готовился следующим образом: навеску 0,01 г пара-нитроанилина растворяют в смеси 10 мл дистиллированной воды и 2,5 мл соляной кислоты. К образовавшемуся раствору прибавляют 2,5 мл раствора натрия азотистокислого и через несколько минут раствор разбавляют водой до 50 мл. Раствор готовят в день проведения анализа. Оптическую плотность определяли при длине волны λ = 440 нм в кювете с рабочей длиной λ = 20 мм, относительно холостой пробы.
Все исследования проводили в трех повторностях.
Результаты исследования и их обсуждение
Для разработки основ использования штаммов грибов рода Trichoderma в целях биодеструкции фенолов необходимо было провести оценку их фенолоксидазной активности. Существуют работы, доказывающие, что ряд штаммов грибов рода Trichoderma способен окислять фенольные соединения [1, 4, 5]. Фенолоксидазную активность грибов обнаруживали в появлении пигмента. В данной работе на основании теста Бавендамма на агаризованной среде с танином установлено, что все исследуемые штаммы растут на питательной среде с таннином, но наибольшую фенолоксидазную активность проявили 3 штамма: Trichoderma asperellum «ТН-11», Trichoderma koningii «ТСГ» и Trichoderma asperellum «Mg-6», диаметр пигментированных пятен составлял 48 ± 0,5, 42 ± 0,5 и 40 ± 0,3 мм соответственно. Изолят Trichoderma viride «Lg-1» не проявил оксидазную активность и в дальнейших исследованиях не использовался.
Проведенные исследования по влиянию фенола на рост штаммов Trichoderma в условиях поверхностного культивирования показали, что они обладают различной чувствительностью к изменению концентрации фенола в среде. Так, при концентрации фенола в среде 20 мг/л наибольшая продуктивность была отмечена у штаммов Trichoderma asperellum «TH-11», Trichoderma koningii «ТСГ» и Trichoderma harzianum «M99/5». При концентрации 50 мг/л – у штаммов Trichoderma asperellum «TH-11» и Trichoderma koningii «ТСГ», а при концентрации фенола в среде 70 мг/л – у штамма Trichoderma koningii «ТСГ». При этом высокие концентрации фенола (50 и 70 мг/л) ингибировали рост штамма Trichoderma harzianum «M99/5». Отрицательное действие фенола на продуктивность штаммов Trichoderma asperellum «Mg-6» и Trichoderma koningii «ТСЛ-06» проявилось при всех концентрациях (рис. 1).
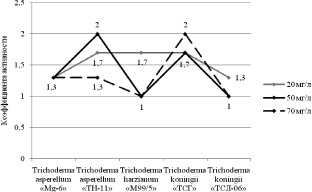
Рис. 1. Коэффициенты активности роста грибов рода Trichoderma в присутствии различных концентраций фенола в среде
Оценку степени биодеструкции фенола исследуемыми штаммами проводили в условиях глубинного культивирования, в качестве источника углерода использовали фенол с концентрациями 20, 50 и 70 мг/л. Концентрацию фенола в среде до и после культивирования определяли фотоколориметрическим методом.
Анализ результатов экспериментальных испытаний показал, что во всех случаях штаммы рода Trichoderma способны подвергать деструкции фенол, содержащийся в среде. Добавление фенола в среду в концентрации 20 мг/л показало, что наибольшую степень деградации проявил штамм Trichoderma harzianum «M99/5» – концентрация снизилась на 30 %. Штаммы Trichoderma asperellum «Mg-6» и Trichoderma koningii «ТСЛ-06» снизили концентрацию на 17,5 и 15 % соответственно, а штаммы Trichoderma asperellum «TH-11» и Trichoderma koningii «ТСГ» – менее чем на 9 %.
При концентрации фенола в среде 50 мг/л характерна наибольшая, по сравнению с другими начальными концентрациями, эффективность биодеструкции. Так, наблюдалось существенное снижение его концентрации штаммом Trichoderma harzianum «M99/5» на 95,5 %, штаммы Trichoderma asperellum «Mg-6» и Trichoderma asperellum «TH-11» снизили концентрацию на 46,6 и 42 % соответственно, штаммы Trichoderma koningii «ТСЛ-06» и Trichoderma koningii «ТСГ» – на 39 %.
При концентрации фенола в среде 70 мг/л штаммы Trichoderma asperellum «TH-11», Trichoderma asperellum «Mg-6» и Trichoderma harzianum «M99/5» снизили его концентрацию на 17,2; 14,3 и 12,9 % соответственно, штаммы Trichoderma koningii «ТСЛ-06» и Trichoderma koningii «ТСГ» – на 11,4 % (рис. 2).
Выводы
Результаты экспериментальных испытаний показали, что исследуемые штаммы видов Trichoderma asperellum, Trichoderma koningii и Trichoderma harzianum проявляют внеклеточную фенолоксидазную активность, но обладают различной чувствительностью к изменению концентрации фенола в среде.
Скрининг штаммов для биодеструкции фенола показал, что при добавлении фенола в качестве единственного источника углерода и энергии в концентрациях 50–70 мг/л при поверхностном культивировании перспективными являются Trichoderma asperellum «TH-11» и Trichoderma koningii «ТСГ», а в условиях глубинного культивирования – Trichoderma harzianum «M99/5», Trichoderma asperellum «Mg-6», Trichoderma asperellum «TH-11», Trichoderma koningii «ТСГ».
В целях создания биопрепарата на основе триходермы при совмещении поверхностного и глубинного принципов культивирования в одной иммерсионной биотехнологической системе можно рекомендовать штаммы Trichoderma asperellum «TH-11» и Trichoderma koningii «ТСГ».
Библиографическая ссылка
Бондарь П.Н., Любяшкин А.В. СКРИНИНГ ШТАММОВ РОДА TRICHODERMA – БИОДЕСТРУКТОРОВ ФЕНОЛА // Фундаментальные исследования. – 2015. – № 12-6. – С. 1091-1094;URL: https://fundamental-research.ru/ru/article/view?id=39735 (дата обращения: 20.04.2024).



