В европейских и российских рекомендациях по профилактике, диагностике и лечению артериальной гипертонии (АГ) особое внимание уделяется определению степени риска, где факторами риска становятся ожирение, гиперлипидемия, а в российских рекомендациях - нарушение толерантности к глюкозе. Метаболические нарушения широко распространены среди взрослого населения, а метаболический синдром (МС) как сочетание АГ с дислипидемией и нарушением толерантности к глюкозе достигает по частоте встречаемости 25-35% в общей популяции [1, 3, 5, 6]. Смертность от сердечно-сосудистых заболеваний среди лиц с МС превышала в 6 раз лиц без этих нарушений, причем к наиболее значимым предикторам смертности при этом относят микроальбуминурию. Наличие метаболических нарушений связывают с утолщением интима медиа сонных артерий, что служит маркером распространенности и выраженности атеросклероза; наличие альбуминурии усугубляет атеросклеротический процесс, определяя поражение почек, выявляемое при сахарном диабете [2]. Важную роль в развитии и прогрессировании АГ играет ожирение. Инсулин способствует ремоделированию сосудов, ускоряет их атероматоз, где АГ приводит к развитию ИР. Следовательно, метаболические нарушения не только ускоряют прогрессирование АГ, но и повышают резистентность артериального давления к стандартному лечению [1]. Приоритетным в лечении АГ становится выбор априорно эффективных лечебных подходов, позволяющих блокировать или ослаблять маркеры сердечно-сосудистого риска.
Цель работы
Изучить функциональное состояние почек у больных артериальной гипертонией, определить роль метаболических нарушений и оценить взаимосвязь с ремоделированием сосудов.
Материалы и методы
Обследовано 45 больных с АГ в возрасте 46-58лет (средний возраст - 51,76±1,56 года). Уровень артериального давления для систолического (САД) составил 148-180 мм рт. ст., диастолического (ДАД) - 95-110 мм рт. ст., уровень липидов в сыворотке крови: общий холестерин (ОХС) ≥ 5,0 ммоль/л, триглицериды (ТГ) ≥ 1,7 ммоль/л, липопротеиды низкой плотности (ЛПНП) ≥3 ммоль/л, коэффициент атерогенности (КА) ≥ 3,5. Абдоминальный тип ожирения - соотношение окружности талии (ОТ) к окружности бедер (ОБ) - ОТ/ОБ ≥0,80; индекс массы тела (ИМТ) ≥ 30 кг/ м2 , гиперинсулинемия (ИРИ) ≥ 18 мкед/ мл, инсулинрезистентность (ИР) как соотношение уровня глюкозы к базальному инсулину ≤ 6.
Для оценки функционального состояния почек исследовали уровень сывороточного креатинина (КК), скорость клубочковой фильтрации (СКФ), по клиренсу эндогенного креатинина, функциональный почечный резерв (ФПН), рассчитывали канальцевую реабсорбцию (КР); экскрецию белка от 30 до 300 мг в суточной моче считали микроальбуминурией (МА). Мониторирование артериального давления (АД) осуществлялось системами полностью автоматического измерения в течение 24 часов с интервалами 15 мин во время бодрствования и 30 мин в ночное время. Определялись средние параметры САД и ДАД за сутки, дневные, ночные; индекс времени (ИВ), вариабельность в разные периоды суток, степень ночного снижения (СИ) САД и ДАД. Эхокардиографическое исследование выполнялось на ультразвуковом аппарате «Aloka SSD - 630» по стандартной методике Американской ассоциации (ASE). Структурно-функциональное состояние перифирических сосудов исследовали путем измерения толщины слоя интима-медиа артерий (ТИМ), общих сонных артерий (ОСА), бедренных артерий (ОБА), где показатель ТИМ > 0,9 мм рассматривали как утолщение интима, а ТИМ≥1,3 мм - критерий атеросклероза. Определялись систолический (DS), диастолический (DD) диаметры ОСА, ОБА и почечной артерии в нескольких сердечных циклах. В изучении почечного кровотока использовались показатели ультразвукового исследования в системе аорта - магистральные почечные артерии (МПА), где изучались скорость систолическая (Vs), скорость диастолическая (Vd), систоло-диастолическое отношение скоростей (S/D), пульсационный индекс Р; и индекс резистентности R. Для оценки баланса депрессорных и прессорных механизмов сосудистой регуляции использовали эндотелийзависимую вазодилатацию на пробу с гиперемией по методике D.S. Celermajer (1992) в модификации О. В. Ивановой (1997). Нормальной реакцией плечевой артерии принимали расширение диаметра на фоне реактивной гиперемии и исходного на 10% и более, меньшая степень вазодилатации или вазоконстрикция считалась патологической реакцией. На основании результатов ультразвукового исследования геометрических параметров артерии и измерения уровня артериального давления были рассчитаны индексы артериальной эластичности как способность артерии изменять свой диаметр в ответ на изменение внутриартериального давления. Определяли артериальный комплайнс (arterial complaiance, AC) как отношение абсолютного приращения внутреннего объема сегмента артерии к пульсовому изменению давления и индекс упругости (stiffness index, SI) - натуральный алгоритм отношения систолического давления крови к диастолическому, разделенному на циркулярное артериальное напряжение, которое выражает увеличение диаметра в течение сердечного цикла.
Обработку результатов исследования проводили методами параметрической и непараметрической статистики с использованием пакета статистических программ
«Microsoft Excel».
Результаты исследования и обсуждение
В процессе исследования были выделены больные с гипертонической болезнью II стадии (ГБ) - 20 человек (44,5%) и 25 больных АГ с ожирением (ИМГ≥30 кг/м2). Согласно критериям ВОЗ, все больные имели умеренную степень повышения артериального давления, где САД составило в среднем для I группы 152,4±1,35 мм рт. ст. и ДАД - 91,4±1,32 мм рт. ст., во второй группе - соответственно 157,6±2,41 и 93,7±0,98 мм рт. ст. Показатели суточного мониторирования выявили укорочение времени с увеличением скорости внутреннего подъема для 1 группы (+25,41 мм рт. ст. и +18,1 мм рт. ст., при норме <10 и <6 мм рт. ст.), повышение ИВ САД до 64,0% и ИВ ДАД до 41,6%. Во второй группе (АГ + ожирение) отмечено недостаточное снижение ночных значений САД и ДАД, повышение СИ ДАД ( +9,7%).
Таким образом, у больных первой группы наряду с повышением показателей САД, ДАД выявлено увеличение индекса времени гипертензии, скорости утреннего подъема с сохранением в целом нормальных показателей вариабельности артериального давления. Во второй группе отмечено значимое увеличение вариабельности артериального давления по сравнению с контрольными величинами (p<0,01), недостаточное снижение ночного давления, а у 9% отрицательные значения СИ с превышением ночного уровня артериального давления. При исследовании ТИМ у больных ОСА I группы отмечено ее повышение на сонной артерии до 0,85 мм±0,01мм (при контроле 0,69±0,012 мм, р<0,05), во второй группе - до 1,31±0,018мм, или на 99,1% (p<0.01), превышая показатели больных I группы на 13% (p>0,05). Полученные изменения ТИМ во 2 группе свидетельствуют о распространении раннего атероматозного процесса в артериальном дереве при наличии ожирения у больных с АГ. Отмечено снижение эластических свойств ОСА и ОБА.
Установлено, что у больных I группы на ОСА и ОБА имелись тенденция к снижению АС и значимое повышение SI ОСА (p<0.05). Во II группе была выделена подгруппа по ИР, которая определила некоторые различия у больных АГ в сочетании с ожирением. Так, при ожирении без ИР оба модуля (AC и SI) значимо ниже на ОСА (1,23±0,24 мм/кПа и 3,98±0,22 соответственно, p<0,05), а на ОБА значимым оказался индекс SI (4,08±0,50 при контроле 3,66±0,53, p<0,05).
У больных АГ с ожирением и ИР оба модуля высоко значимо менялись, где АС ОСА снижался до 1,11±0,10 мм/кПа (при контроле 1,78±0,25 мм/кПа, p<0,01), а АС ОБА - до 1,14±0,12 мм/кПа (в контроле 1,40±0,31 мм/кПа, р<0,05), в то же время индекс упругости Si увеличился до 4,03±0,24 и 4,56±0,32 (p<0,01), что указывало на усиление ригидности сосудов при сочетании АГ с ожирением и ИР. Усиление упругости сонной артерии у больных АГ происходит больше за счет изменения внутренних свойств артериальной стенки, зависит от толщины сосудистой стенки, внутриартериального давления. На бедренной артерии больше нарастает индекс упругости SI как независимый показатель от внутриартериального давления и определяет степень ригидности самого сосуда. Однако оба показателя значимо меняются с нарастанием нарушений метаболизма, где ИР становится предиктором ригидности сосудистой стенки.
Изучение почечного кровотока выявило изменение показателей, свидетельствующих о нарушении функциональных свойств почечных артерий (табл. 1).
Таблица 1. Гемодинамические показатели МПА у больных артериальной гипертонией с метаболическими нарушениями
|
|
Контроль (1) n=20 |
ГБ(2) n=20 |
АГ |
P |
|
|
ожирение(3) n=14 |
ожирение+ИР(4) n=11 |
||||
|
Vs |
0,67±0,14 |
0,573±0,08 |
0,536±0,08 |
0,523±0,07 |
P1-3<0,05 P1-4<0,05 |
|
Vd |
0,26±0,05 |
0,20±0,05 |
0,214±0,03 |
0,206±0,03 |
P1-4<0,05 |
|
S/D |
2,63±0,23 |
2,60±0,18 |
2,55±0,43 |
2,70±0,52 |
P>0,05 |
|
Pi |
1,07±0,12 |
1,06±0,11 |
1,06±0,20 |
1,216±0,22 |
P1-4<0,05 |
|
Ri |
0,62±0,03 |
0,60±0,04 |
0,59±0,05 |
0,65±0,10 |
>0,05 |
Максимальные и минимальные скорости кровотока (Vs и Vd) статистически значимо снижены у больных АГ с ожирением (P<0,05), различия в Pi и Ri отсутствовали у больных АГ по отношению к группе контроля, значимо увеличивался показатель Pi только у больных АГ в сочетании с ожирением и ИР, что, вероятно, определялось повышением вариабельности САД и ДАД в группе пациентов с ИР. Увеличение пульсационного (Pi) и резистентного (Ri) индексов отражают нарушение почечного кровотока с повышением внутрипочечного периферического сопротивления и свидетельствуют о ранней доклинической стадии нарушения почечного кровотока.
Изучение показателей эластических свойств почечных артерий у больных АГ в зависимости от метаболических нарушений представлено в табл. 2.
Установлено достоверное снижение эластичности МПА по отношению к контрольной группе, что выражается в уменьшении АС у больных АГ в сочетании с ожирением на 61% (p<0,05) и на 106% при АГ с ИР (p<0,01). Показатель Si также значимо нарастал у больных АГ с метаболическими факторами, но был менее выражен, чем данных ОСА.
Таблица 2. Показатели эластичности ОСА и МПА у больных АГ
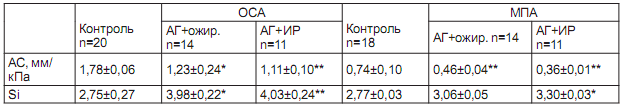
Примечание: * достоверность с группой контроля - p<0.05; ** - p<0.01
Таблица 3. Функциональное состояние почек в обследуемых группах (M+-m)
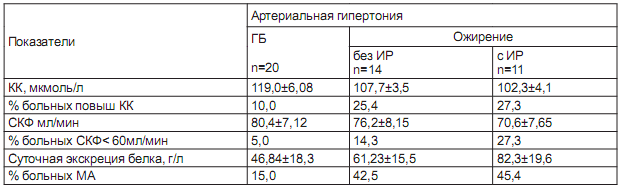
Повышенный уровень сывороточного креатинина достоверно чаще встречался у больных АГ с ожирением. Суточная экскреция альбумина была также выше у больных второй группы, но значима только при АГ в сочетании СИР (p<0.05).
Самый высокий показатель МА отмечен у больных АГ с ожирением и ИР (82,3±19,6 г/л) и выявлен у 45,4% против 15,0% больных с ГБ. В целом у больных АГ в сочетании с метаболическими нарушениями чаще развивается кардиоренальный синдром с умеренным нарушением азотвыделительной функции почек, обнаруживается микроальбуминурия. Высокие значения уровня артериального давления и развитие ИР приводят к ухудшению показателей функционального состояния почек, появляются на фоне повышенной ригидности МПА. Микроальбуминурия, снижение скорости клубочковой фильтрации, нарастание уровня креатинина становятся основными проявлениями кардиоренального синдрома у больных АГ в сочетании с ожирением, где ИР является предуктором этих нарушений и причиной развития и прогрессирования поражения почек. Оценка эндотелиальной функции у больных АГ выявила недостаточную и даже парадоксальную реакцию эндотелия, что проявилось снижением прироста диаметра плечевой артерии в ответ на пробу с реактивной гиперемией в обеих группах пациентов. Для больных ГБ он составил 9,5±0,12% (p<0.05), для АГ с ожирением - 8,34 ± 0,25% и при сочетании с ИР - 6,95± 0,17% (p<0.01), у 23% больных второй группы отмечена парадоксальная реакция. Индекс пульсации PI плечевой артерии повышался параллельно снижению скорости кровотока с 7,791±0,10 у больных ГБ до 8,07± 0,12 и 8,28±0,13 при АГ в сочетании с ожирением и ИР соответственно (контроль 7,02±0,08, p<0.01).
Одной из вероятных причин нарушения вазомоторной функции эндотелия при АГ можно считать ригидность сосудов, более выраженную при ожирении, о чем свидетельствуют показатели эластичности АС и SI, а ИР выступает как предиктор развития ремоделирования сосудистой стенки. Обнаружена позитивная корреляционная связь средней силы с показателями структуры сосудов у больных АГ с ожирением: AC OCA (r=+0,82; p<0,01) SI (r=+0,61; p<0,05), что указывает на возможность непосредственного участия ожирения в ремоделировании периферических сосудов. Реакция артерий на фоне реактивной гиперемии обратно коррелировала с метаболическими факторами (r=-0,5, p=0,002), из которых наиболее высокая связь обнаружена между ИР и снижением реакции на эндотелийзависимый стимул (r=-0,39; p=0,004); кардиоренальный синдром у больных АГ становится проявлением этих нарушений, усиливается при сочетании с ожирением и ИР.
СПИСОК ЛИТЕРАТУРЫ
- Задионченко В.С., Адашева Т.В., Демичева О.Ю. и др. Артериальная гипертензия при метаболическом синдроме // Consilium medicum. - 2004, 6(9): 63-65.
- Недогода С. В. Возможности антигипертензивной терапии в предотвращении кардиоренального континуума // Артериальная гипертензия. - 2006, 12(4): 336- 338.
- Чазова И. Е., Мичка В. Б. Метаболический синдром media medica, 2004.
- European Society of Hypertension, 2003// J. Hypertens. - 2003, 21: 1011-1053.
- Jsomaa B., Almgren P., Tuomi T. ex al. cardiovas cular morbidity and mortality associated with metabolic syndrome// Diabetes care. - 2007, 24(4): 683-689.
- Ford E.S., Giles W.H., Dietz W.H. Prevalence of metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey// JAMA. - 2002, 287 (3): 356-359.
- Susic D. Renal protective potential of antihypertensive drugs // Expert Opin Invent Drugs. - 2000, 9: 2593 - 2600.
Библиографическая ссылка
Г.А. Грицаенко, Л.Н. Хусаинова, И.Г. Беляева, Л.Н. Мингазетдинова КАРДИОРЕНАЛЬНЫЙ СИНДРОМ КАК ПРЕДИКТОР РЕМОДЕЛИРОВАНИЯ СОСУДОВ У БОЛЬНЫХ АРТЕРИАЛЬНОЙ ГИПЕРТОНИЕЙ // Фундаментальные исследования. – 2010. – № 3. – С. 37-43;URL: https://fundamental-research.ru/ru/article/view?id=6653 (дата обращения: 20.04.2024).



