Клинические и эпидемиологические исследования последних двух десятилетий показали, что повышенный уровень гомоцистеина в плазме крови является мощным независимым фактором риска для атеросклероза в общей популяции [13]. Гипергомоцистеинемия повышает риск развития сердечно-сосудистых заболеваний (ССЗ): ишемической болезни сердца (в т.ч. инфаркта миокарда), церебрального ишемического инсульта, облитерирующего атеросклероза нижних конечностей, тромбоза артерий и вен [4], хронической сердечной недостаточности [11] и ухудшает прогноз при этих патологиях.
Одним из органов, наиболее чувствительных к повышенным концентрациям гомоцистеина, является сердце. При этом большинство исследований, посвященных выяснению роли гомоцистеина в патогенезе ССЗ, ограничивается лишь изучением повреждающего действия этой аминокислоты на сосудистую стенку и выявлением взаимосвязи между развитием ССЗ и уровнем гомоцистеина в плазме крови. В то же время гомоцистеин образуется из метионина практически во всех типах клеток, а не только в эндотелии сосудов. Концентрация гомоцистеина в плазме крови является лишь отражением его метаболизма в тканях. Так как механизмы повреждающего действия гомоцистеина неспецифичны, – разрушение дисульфидных связей в белках, нарушение реакций трансметилирования, усиление перекисного окисления белков и липидов [10], – следует учитывать прямое повреждающее действие этой аминокислоты на клетки тканей, в которых она образуется, и, в том числе, на кардиомиоциты.
Важным фактором, оказывающим негативное воздействие на клетки при гипергомоцистеинемии, является митохондриальная дисфункция. Её развитие связывают с увеличением продукции активных форм кислорода и снижением доступности оксида азота (NO) под действием гомоцистеина [14]. Значение NO как регулятора функции митохондрий активно изучается. Следует отметить, что в митохондриях кардиомиоцитов доказано наличие NO-синтаз (NOS). Из-за сходства аминокислотного состава многие исследователи относят их соответственно к NOS-1 (нейрональной) и NOS-2 (индуцибельной) [9].
Известно, что NO способен ингибировать цитохром-с-оксидазу и аконитатгидратазу [12]. Изменение синтеза NO является механизмом адаптации митохондрий кардиомиоцитов к гипоксии в условиях ишемии миокарда. Кроме того, эффекты NO могут реализовываться путём воздействия на гемсодержащие белки и тиолы. Также NO способен в зависимости от условий проявлять как про- [9], так и антиоксидантные свойства [15].
По всей видимости, снижение доступности оксида азота является важным звеном в патогенезе дисфункции митохондрий при гипергомоцистеинемии. В то же время, механизм действия гомоцистеина на метаболизм оксида азота остаётся неизвестным.
Цель исследования: изучить взаимосвязь функционирования оксидоредуктаз митохондрий клеток сердца, процесса окислительного карбонилирования белков и уровня метаболитов NO в них при экспериментальной гипергомоцистеинемии.
Материалы и методы исследования
Объектом исследования служили 12 крыс-самцов линии Wistar. Работа с животными осуществлялась в соответствии с «Европейской конвенцией о защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1986), приказом Министерства здравоохранения и социального развития Российской Федерации от 23 августа 2010 г. № 708н «Об утверждении правил лабораторной практики» и приказом Минздрава СССР от 12.08.1977 г. № 755 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных».
Крысы были разделены на 2 группы по 6 животных. Первая группа использовалась для моделирования гипергомоцистеинемии. С этой целью применяли метод, предложенный С.Г. Емельяновым с соавторами в нашей модификации [5]: внутрижелудочное введение в течение 21 дня 25 %-й суспензии метионина в дозе 3 г/кг с добавлением 1 % метионина в питьевую воду. Вторая группа служила контрольной. Этим крысам вводилась суспензионная основа, не содержащая метионин (состав по массе: 10 % твина-80, 1 % крахмала, 89 % воды). Умерщвление животных осуществлялось под эфирным наркозом путём вскрытия брюшной полости и пересечения брюшной аорты. При этом отбиралась кровь и сердце. Все дальнейшие манипуляции по извлечению митохондрий проводили при температуре не выше 4 °С. Среда выделения для сердца имела следующий состав: 0,25 М сахарозы, 0,001 М ЭДТА и 0,05 М трис-буфер [7]. От сердца отделяли левый желудочек, который затем гомогенизировали на гомогенизаторе «Potter S» в среде выделения. Митохондрии получали методом дифференциального центрифугирования [7]. Осадок, содержащий митохондрии, ресуспендировали в среде выделения. Для анализа использовались суспензия митохондрий, цитоплазматическая фракция и сыворотка крови.
В сыворотке крови определяли концентрацию гомоцистеина набором для иммуноферментного анализа производства «Axis Shield» и концентрацию метаболитов оксида азота (нитритов и нитратов) методом в модификации В.А. Метельской по реакции диазотирования и азосочетания [6].
В цитоплазматической фракции определяли содержание лактата с помощью набора производства Ольвекс-диагностикум спектрофотометрически лактатоксидазным методом.
В суспензии митохондрий спектрофотометрически измеряли: общий белок методом Лоури набором производства «Экосервис»; концентрацию метаболитов оксида азота (также как и в сыворотке), активность сукцинатдегидрогеназы (СДГ) по реакции восстановления гексацианоферрата (III) калия [7]; активность Н+-АТФ-азы, измеряя содержание неорганического фосфата методом Боданского после остановки реакции гидролиза АТФ [1]; активность супероксиддисмутазы (СОД) по торможению реакции аутоокисления кверцетина [3]; активность лактатдегидрогеназы (ЛДГ) и α-гидроксибутиратдегидрогеназы (α-ГБДГ) с помощью наборов производства DiaSys. Окислительную модификацию белков (ОМБ) оценивали по методу R.L. Levine в модификации Е.Е. Дубининой [2], который основан на реакции взаимодействия карбонильных групп и иминогрупп окисленных аминокислотных остатков с 2,4-динитрофенилгидразином (2,4-ДНФГ) с образованием 2,4-динитрофенилгидразонов, обладающих специфическим спектром поглощения в ультрафиолетовой и видимой областях спектра. Затем проводили расчет доли ранних и поздних маркеров окислительной деструкции белков, а также анализ резервно-адаптационного потенциала [8].
Статистическую обработку результатов проводили с помощью программ MS Excel и Statplus 2009 Portable. Соответствие выборок нормальному распределению проверяли с помощью критерия Шапиро-Уилка. Так как распределение отличалось от нормального, для проверки достоверности отличий значений в контрольной и опытной группах использовали непараметрический U-критерий Манна-Уитни. Отличия считали статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение
Результаты исследования приведены в табл. 1–4 и на рис. 1–3.
Из табл. 1 видно, что введение метионина в дозе 3 г/кг в течение 3 недель с добавлением его в питьевую воду вызывает у крыс развитие тяжёлой гипергомоцистеинемии – уровень гомоцистеина в сыворотке крови животных увеличивается более чем в 50 раз. Это сопровождается заметным снижением сывороточного уровня метаболитов оксида азота.
Таблица 1
Биохимические показатели сыворотки крови крыс. Результаты представлены в форме: медиана [1-й квартиль; 3-й квартиль]
|
Показатель |
Контроль |
Гипергомоцистеинемия |
p |
|
Концентрация гомоцистеина, мкмоль/л |
5,8 [5,6; 5,8] |
291,65 [277,38; 334,43] ↑в 50 раз |
0,025 |
|
Концентрация метаболитов NO, мкмоль/л |
54,74 [47,41; 57,67] |
40,08 [37,63; 43,11] ↓26,8 % |
0,025 |
Таблица 2
Содержание лактата в неседиментированной (цитоплазматической) фракции клеток сердца. Результаты представлены в форме: медиана [1-ый квартиль; 3-ий квартиль]
|
Показатель |
Контроль |
Гипергомоцистеинемия |
p |
|
Концентрация лактата, ммоль/г белка |
0,93 [0,64; 1,33] |
1,02 [0,84; 1,18] ↑9,7 % |
0,7728 |
Таблица 3
Биохимические показатели митохондрий сердца крыс. Результаты представлены в форме: медиана [1-ый квартиль; 3-ий квартиль]
|
Показатель |
Контроль |
Гипергомоцистеинемия |
p |
|
Общий белок митохондриальной фракции, мг/мл |
7,44 [6,41; 8,86] |
8,27 [6,54; 10,25] ↑11,1 % |
0,7488 |
|
Концентрация метаболитов NO, мкмоль/г белка |
59,6 [56,32; 66,89] |
49,1 [34,47; 55,44] ↓17,62 % |
0,0374 |
|
Активность СОД, УЕ/мг белка |
0,40 [0,28; 0,43] |
1,44 [0,65; 4,47] ↑в 3,6 раза |
0,025 |
|
Активность СДГ, нмоль сукцината/мг белка в минуту |
276,12 [251,91; 282,25] |
168,61 [81,77; 289,90] ↓38,9 % |
0,4233 |
|
Активность Н+-АТФ-азы, мкмоль фосфата/мг белка в час |
13,15 [11,52; 14,26] |
12,36 [10,28; 13,61] ↓6 % |
0,631 |
|
Активность α-ГБДГ, ЕД/г белка |
220,99 [202,25; 241,87] |
136,74 [130,28; 169,95] ↓38,1 % |
0,1093 |
|
Активность ЛДГ, ЕД/г белка |
221,22 [186,91; 261,48] |
379,45 [318,11; 410,37] ↑71,5 % |
0,0163 |
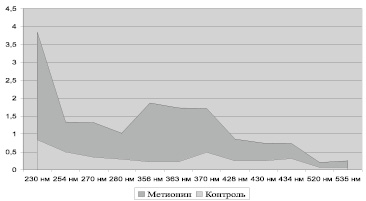
Рис. 1. Содержание карбонилированных производных белков в митохондриях клеток сердца крыс, у.е./г белка
Таблица 4
Содержание карбонилированных производных белков в митохондриях клеток сердца крыс, у.е./г белка. АДНФГ – альдегиддинитрофенилгидразоны, КДНФГ – кетондинитрофенилгидразоны, S – площадь под кривой (рис. 1), uv – в ультрафиолетовой области спектра, vs – в видимой области спектра
|
S АДНФГ uv |
S КДНФГ uv |
SАДНФГ vs |
S КДНФГ vs |
S ОМБ |
|
|
Контроль |
472,236511 |
236,836497 |
142,42719 |
20,9230948 |
872,4233 |
|
Метионин |
2170,23936* |
864,653047* |
484,97579* |
63,1757238* |
3583,044* |
Примечание. *p < 0,05.
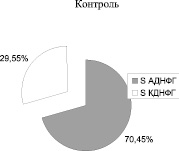
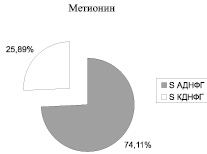
Рис. 2. Соотношение ранних (АДНФГ) и поздних (КДНФГ) маркеров окислительной деструкции белков в митохондриях кардиомиоцитов крыс
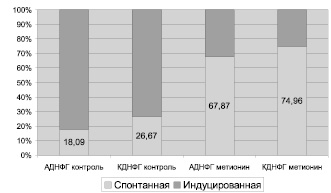
Рис. 3. Резервно-адаптационный потенциал белков митохондрий кардиомиоцитов крыс (процент показателей спонтанной ОМБ относительно металл-индуцированной, значения металл-индуцированной ОМБ приняты за 100 %)
Введение метионина приводит к заметному повышению активности СОД (табл. 3) и нарастанию содержания карбонилированных производных белков в митохондриях клеток сердца (рис. 1, табл. 4). При этом наблюдается статистически значимое нарастание как альдегиддинитрофенилгидразонов (АДНФГ), являющихся ранними маркерами окислительного повреждения белков, так и кетондинитрофенилгидразонов (КДНФГ) – поздних маркеров ОМБ [8]. Соотношение АДНФГ и КДНФГ существенно не изменяется (рис. 2). В группе с гипергомоцистеинемией наблюдается увеличение отношения продуктов спонтанного окисления к индуцированному с помощью реакции Фентона (рис. 3). Это указывает на снижение в экспериментальной группе резервно-адаптационного потенциала митохондрий кардиомиоцитов относительно контроля [8].
У группы животных, получавших метионин, в митохондриях клеток сердца наблюдается хоть и статистически недостоверное, но всё же падение активности митохондриальных ферментов, участвующих в аэробном окислении и окислительном фосфорилировании – СДГ, Н+-АТФ-азы, α-ГБДГ (отражает суммарную активность ЛДГ1 и ЛДГ2, так как только эти 2 изофермента ЛДГ способны превращать α-гидроксибутират) (табл. 3). Причиной этого может являться повреждение белков в результате оксидативного стресса, на что указывают данные оценки ОМБ.
По всей видимости, в условиях гипергомоцистеинемии для кардиомиоцитов возрастает значение анаэробного гликолиза как источника АТФ. На это указывает нарастание уровня лактата в гиалоплазме (табл. 2) и увеличение суммарной активности ЛДГ на фоне снижения активности ЛДГ1 и ЛДГ2 (табл. 3), так как остальные изоферменты ЛДГ обладают большим сродством к лактату и наиболее активны в анаэробных условиях.
Указанные изменения сопровождаются снижением концентрации в митохондриях сердца стабильных метаболитов оксида азота – нитритов и нитратов (табл. 3). Причиной такого изменения может быть дефицит восстановителей (в т.ч. тетрагидробиоптерина-кофермента NOS) из-за оксидативного стресса, ведь в таких условиях NOS не только не продуцирует NO, но и синтезирует активные формы кислорода (АФК) – супероксидный анион-радикал и перекись водорода [9]. С другой стороны, снижение содержания NO само по себе может потенцировать развитие оксидативного стресса, так как в физиологических концентрациях NO выступает как антиоксидант. Его антиоксидантное действие обусловлено торможением развития радикальных окислительных реакций за счёт связывания со свободными и входящими в состав гема ионами железа и ингибирования реакции Фентона. Образуя с ионами железа нитрозильный комплекс, NO предотвращает взаимодействие с ним супероксидного аниона и, следовательно, образование сильнейшего окислителя – гидроксильного радикала. Продуктом реакции NO с супероксидным анионом является более слабый окислитель – пероксинитрит, который, при отсутствии других свободых радикалов, быстро превращается в нетоксичный нитрат. Также антиоксидантное действие NO связывают с прерыванием цепных радикальных реакций с участием пероксидов липидов [30]. Таким образом, гиперпродукцию АФК и дефицит оксида азота, обладающего антиоксидантными свойствами, можно рассматривать как звенья одного порочного круга патогенеза.
Выводы
Гипергомоцистеинемия у крыс, вызванная трёхнедельным введением метионина, сопровождается изменениями биохимических показателей митохондрий кардиомиоцитов, проявляющимися в развитии оксидативного стресса с усилением окислительного карбонилирования белков и снижении концентрации метаболитов NO. Оксидативный стресс в значительной мере компенсируется за счёт активации системы антиоксидантной защиты (в т. ч. посредством СОД), о чём свидетельствует незначительное снижение активности митохондриальных оксидоредуктаз (СДГ, Н+-АТФ-азы, α-ГБДГ) и несущественное нарастание уровня лактата, отсутствие увеличения доли поздних маркеров окислительного повреждения белков при истощении резервно-адаптационного потенциала.
Рецензенты:Емельянова А.С., д.б.н., профессор кафедры технологии производства и переработки продукции животноводства, ФГБОУ ВПО «Рязанский государственный агротехнологический университет имени П.А. Костычева», г. Рязань;
Булатецкий С.В., д.м.н., профессор кафедры уголовного процесса и криминалистики, полковник полиции, Рязанский филиал ФГКОУ ВПО «Московский университет МВД России имени В.Я. Кикотя», г. Рязань.
Работа поступила в редакцию 19.02.2015.
Библиографическая ссылка
Медведев Д.В., Звягина В.И. МЕТАБОЛИЗМ МИТОХОНДРИЙ КЛЕТОК СЕРДЦА ПРИ ЭКСПЕРИМЕНТАЛЬНОЙ ГИПЕРГОМОЦИСТЕИНЕМИИ У КРЫС // Фундаментальные исследования. – 2015. – № 2-4. – С. 734-739;URL: https://fundamental-research.ru/ru/article/view?id=36923 (дата обращения: 26.04.2024).



