Актуальность. Парентеральные вирусные гепатиты В и С во всем мире являются одной из актуальных медико-социальных проблем в связи с широкой распространенностью [6] и высокой частотой развития хронических форм инфекции [3, 6]. Клинические проявления хронических вирусных гепатитов (ХВГ), включая интоксикационный синдром, у детей слабо выражены [5]. Для диагностики эндотоксикоза возможно исследование спектральных характеристик веществ низкой и средней молекулярной массы крови (ВНСММ), определение их уровней и соотношения позволяет дать комплексную оценку метаболического статуса организма и стадии эндогенной интоксикации [1, 2]. Однако в детском возрасте такие работы не проводились. В течение последних 25 лет «Золотым стандартом» в лечении хронического гепатита С (ХГС) является терапия интерфероном-α (IFN-α), максимальная эффективность которой достигается при использовании пегилированных интерферонов-α в сочетании с синтетическими аналогами нуклеозидов. В то же время возрастные ограничения и значительные финансовые затраты снижают частоту их применения в детской практике. Кроме того, проведение противовирусной терапии (ПВТ) сопряжено с рядом побочных явлений, выраженность которых дозозависима. В настоящее время известен способ, позволяющий выбрать оптимальный препарат и его дозу для каждого больного индивидуально, основанный на определении тиолдисульфидного соотношения в сыворотке крови. В детской практике изучение данной методики не проводилось. Все это диктует необходимость отработки у детей персонифицированного подхода к лечению ХВГ с целью увеличения эффективности терапии и снижения частоты побочных эффектов.
Цель исследования: изучить клинико-лабораторные особенности течения ХГВ и С у детей и оценить возможность персонифицированного подбора ПВТ с целью повышения эффективности лечения.
Материалы и методы исследования
Проведено клинико-лабораторное обследование 107 детей, в возрасте от 3 до 18 лет, больных ХГВ и С (ХГВ - 15 чел. - 14 %, ХГС - 92 чел. - 86 %). Этиология заболевания устанавливалась на основании выявления антигенов вирусов гепатита и специфических антител к ним в крови методом ИФА и обнаружению ДНК или РНК вирусов при помощи качественной или количественной реакции ПЦР. При оценке состояния детей учитывались жалобы, данные объективного осмотра. Наряду со стандартными биохимическими исследованиями изучены уровни ВНСММ в крови у 24 пациентов по методу М.Я. Малаховой (1995 г.) в модификации (Л.А. Алексеева, 2006 г.). Всем детям в динамике проводилось УЗИ брюшной полости на аппарате Siemеns Sonoline G 60. Для определения степени фиброза печени 5 подросткам выполнена пункционная биопсия печени традиционным чрезкожным методом под контролем УЗИ и 39 детям проведена эластография с помощью аппарата «FibroScan». Использован индекс гистологической активности (ИГА), предложенный R.Knodell (1981), оценка степени фиброза проводилась с учетом шкалы METAVIR. Подбор индивидуальной ПВТ проводился 24 детям, исходя из изучения влияния различных доз противовирусных препаратов «in vitro» на величину тиолдисульфидного соотношения крови больных. Наиболее эффективной считалась та доза препарата, при инкубации с которой коэффициент SH/SS превышал контрольное значение [4]. Клинико-лабораторный мониторинг проводился через 1, 3, 6, 9, 12 месяцев от начала лечения, с последующим контролем через 6-12 месяцев после окончания терапии.
Результаты и их обсуждение
При изучении сроков инфицирования выявлено, что среди наблюдаемых детей практически половина пациентов (44,8 %) имела длительность заболевания более 10 лет. Характер течения инфекции был первично-хроническим, так как ни один ребенок не имел указаний на ранее перенесенный острый гепатит, и заболевание выявлялось, как правило, случайно. При анализе клинической картины было выявлено, что те минимальные проявления заболевания, которые имели место в 40,0 % при ХГВ и 40,2 % у больных с ХГС, носили астеновегетативный и диспептический характер и являлись проявлением интоксикационного синдрома, а у ряда больных были связаны с сопутствующей патологией, поскольку у 39,5 % детей встречалось поражение желудочно-кишечного тракта. Изучение активности инфекции у больных ХГВ и С проводилось по наличию репликации вируса, уровню вирусной нагрузки, а также по степени выраженности синдрома цитолиза и изменению других биохимических показателей. Репликация вируса обнаружена у 90,2 % больных ХГС и 80 % пациентов с хронической HBV - инфекцией. Наиболее часто (41,7 %) у лиц, инфицированных HC - вирусом, отмечен высокий уровень виремии (более 1млн МЕ/мл), средний (от 100 тыс. до 1 млн МЕ/мл) встречался у 37,5 %, а низкую вирусную нагрузку (менее 100 тыс. МЕ/мл) имели 20,8 % больных. Выявлено превалирование (57,9 %) 1в генотипа вируса гепатита С, 3а генотип составил 33,7 %, 1а - 2,4 %, а сочетание нескольких генотипов: 1а + 1в, 1а + 2, 1в + 2, 1в + 3а имело место в 4,8 % случаев. У одного ребенка в ходе исследования генотип установить не удалось. Преобладание 1в генотипа обусловлено специфичностью отобранной группы пациентов, так как в ней большое число составили дети, которым ранее была проведена ПВТ, но они имели либо ускользание ремиссии, либо не отвечали на лечение вовсе, а связь 1в генотипа вируса с низким ответом на ПВТ широко известна. Цитолитический синдром, как и клиническая симптоматика, у обследованных детей был выражен достаточно слабо - в основном регистрировалась минимальная (до 46,7 %) и низкая (30,4 %) биохимическая активность, а в 56,5 % случаев у больных ХГС и 33,3 % при ХГВ отмечались нормальные показатели печеночных ферментов.
Проведен анализ лабораторных показателей тяжести эндогенной интоксикации (определение ВНСММ в плазме и эритроцитах крови и их соотношения) и сопоставление обнаруженных изменений с длительностью и активностью патологического процесса. У всех обследованных больных выявлены лабораторные признаки эндогенной интоксикации в виде увеличения ВНСММ плазмы в 1,5 раза, а эритроцитов ‒ в 1,2 раза по сравнению с нормой. Коэффициент распределения, характеризующий детоксикационные возможности системы крови, был также увеличен у детей с ХГВ и С в 1,2-2 раза. У больных с длительностью болезни свыше 10 лет зарегистрирован достоверно увеличенный уровень ВНСММ плазмы и К распределения, по сравнению с пациентами, у которых длительность болезни была менее 10 лет (табл. 1). Отмечена тенденция к нарастанию ВНСММ эритроцитов у больных со сроком заболевания от 1 года до 5 лет, возможно, это повышение на ранних стадиях болезни связано с компенсаторным увеличением сорбционной способности гликокаликса эритроцитов. При анализе спектральных характеристик ВНСММ крови в зависимости от биохимической активности процесса статистически достоверных различий не получено, но отмечена тенденция к увеличению ВНСММ плазмы и коэффициента распределения у детей, которые имели концентрацию АлАТ в 1,5-2,5 раза выше нормы.
Таблица 1
Уровень веществ низкой и средней молекулярной массы при хронических гепатитах В и С у детей с различной длительностью заболевания
|
Длительность |
Количество |
Средние значения показателей эндогенной интоксикации (Хср. ± δ) у.е. |
||
|
ВНСММ плазмы |
ВНСММ |
К распределения |
||
|
1‒5 лет |
6 |
9,15 ± 0,41* |
26,92 ± 2,06 |
0,35 ± 0,03* |
|
5‒10 лет |
11 |
10,8 ± 0,63* |
23,97 ± 0,89 |
0,45 ± 0,03 |
|
Более 10 лет |
6 |
13,2 ± 0,61* |
24,72 ± 2,14 |
0,54 ± 0,03* |
Примечание: * - достоверное отличие (р < 0,05) между группами детей, больных ХГ более 10 лет, и с более коротким сроком инфицирования (1‒5 и 5‒10 лет).
Таким образом, выявление уровня ВНСММ плазмы выше 7,24 у.е., эритроцитов - выше 20,14 у.е. и К распределения крови более 0,35 у.е., у детей, больных ХГВ и С, в том числе с минимальными клиническими проявлениями заболевания и отсутствием биохимической активности, указывает на наличие эндогенной интоксикации и необходимость проведения патогенетической мембраностабилизирующей терапии.
Всем детям для оценки изменения размеров печени, ее структуры, состояния кровотока, а также степени выраженности соединительной ткани проводилось УЗИ брюшной полости. В 24,2 % случаев отмечались лишь умеренная гепатомегалия и изменения со стороны желчного пузыря в виде деформации, уплотнения стенок и/или изменения размеров органа. УЗИ - признаков фиброза и портальной гипертензии у данной группы пациентов зарегистрировано не было. Анализ 5 пункционных биоптатов подростков с ХГВ и С, инфицированных в раннем возрасте, показал, что несмотря на длительность заболевания у них регистрировалась низкая или умеренная активность процесса (ИГА 3-7 баллов) с признаками фиброза F0-1. Принимая во внимание малое количество проведенных пункционных биопсий и то, что УЗИ исследование не может в полной мере отразить все морфологические нарушения печени, в частности степень фиброза, 13 больным с ХГВ и 26 - с ХГС была осуществлена непрямая эластография с использованием аппарата «FibroScan». Оценка степени фиброза проводилась с учетом шкалы METAVIR. Результаты данного исследования, средние показатели которого представлены в табл. 2, показали, что ни у одного больного не было зафиксировано наличия цирротических изменений. Хотя у одного пациента с ХГВ 17 лет, инфицированного в возрасте 1 года, имеющего нормальный уровень АлАТ (24,0 Ед/л), показатель (11,7 кПа) соответствовал F3. Зафиксирован фиброз 1-й степени еще у двух пациентов с ХГВ и у одного с ХГС. Уровень биохимической активности у данных больных был в пределах нормы, а длительность болезни составляла 14, 18 и 11 лет. Средний показатель эластографии всей обследуемой группы - 4,6 ± 0,2 кПа соответствовал рангу F0. Таким образом, по результатам непрямой эластографии у группы пациентов с ХГВ и ХГС со средней продолжительностью заболевания 10,1 ± 0,6 лет выявлены признаки фиброза печени у 10 % больных. Это еще раз свидетельствует о низких темпах прогрессирования фиброза у лиц, инфицированных в раннем детстве.
Таблица 2
Результаты эластографии детей, больных ХГВ и С
|
|
Длительность болезни |
Уровень АлАТ (Ед/л) |
Средний |
Число больных |
|
ХГВ (n = 13) |
10,0 ± 1,2 |
44,3 ± 9,7 |
5,3 ± 0,5/F0 |
2 (F1) 1 (F3 ) |
|
ХГС (n = 26) |
10,2 ± 0,8 |
54,9 ± 7,8 |
4,3 ± 0,1/F0 |
1 (F1) |
|
Всего (n = 39) |
10,1 ± 0,6 |
51,4 ± 6,1 |
4,6 ± 0,2/F0 |
4 - (F1, F3) |
В ходе скрининга было отобрано 24 ребенка с ХГС в возрасте от 5 до 18 лет, которые на момент обследования нуждались в проведении ПВТ. До начала терапии всем пациентам «in vitro» проводилось тестирование крови с препаратами IFN-α в различных дозах и с комбинацией 2-х препаратов (сочетание различных IFN-α с Рибамидилом и/или Циклофероном). Для этого к венозной крови больного добавляли препараты в различных разведениях, инкубировали в термостате в течение 1 часа, после чего происходило гемолизирование эритроцитов. Далее как в контроле, так и при соединении лекарственных препаратов с помощью спектрофотометрии изучалось содержание SH-, SS-групп, а также соотношение SH/SS. При этом повышение данного соотношения по сравнению с контролем рассматривалось как положительный результат, а его понижение - как отрицательная реакция на препарат. Из тестируемых доз препаратов выбирали ту, при которой коэффициент
SH/SS приближался к максимальным значениям. Таким образом, для каждого больного моделировалось 10 возможных вариантов терапии. Отмечена хорошая чувствительность к препаратам отечественного производства (79 %), превышающая зарубежные препараты (54,02 %), что является важным в экономическом плане для снижения затрат на терапию. Чувствительность к малым дозам IFN-α (1, 2 млн МЕ) оказалась сопоставимой со стандартными терапевтическими дозировками и была отмечена у 40,6 % пациентов. Таким образом, для лечения 15 детей, больных ХГС, нами были использованы лекарственные средства отечественного производства: Интераль 3 млн МЕ (И3), Альтевир 3 млн МЕ (А3), индуктор эндогенного интерферона - Циклоферон (ЦФ). И у 9 человек ПВТ была проведена препаратом зарубежного производства - Роферон А в дозах 1, 2 и 3 млн МЕ (Р1, Р2, Р3). В составе комбинированной схемы лечения у 10 подростков применен синтетический аналог нуклеозидов - Рибамидил (Р600, Р800) и у 2 пациентов ‒ Ребетол (Реб600) (рисунок). Кратность и способ введения противовирусных средств были стандартными: препараты IFN-α применялись подкожно (п/к) или внутримышечно (в/м), 3 раза в неделю, индуктор эндогенного интерферона - Циклоферон на начальных этапах лечения в/м, затем внутрь, также 3 раза в неделю и синтетический аналог нуклеозида - внутрь, ежедневно. Дозы и выбор препаратов осуществлялись исходя из результатов, полученных при проведении теста на чувствительность к противовирусным средствам у каждого конкретного пациента индивидуально.
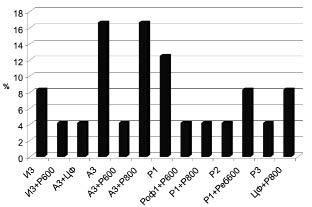
Частота применения различных схем терапии у детей, больных ХГС
В результате исследования установлено, что при индивидуальном подборе противовирусных средств для лечения ХГС ранний вирусологический ответ (РВО) - нормализация уровня активности трансаминаз и/или исчезновение RNА HCV через 12 недель от начала терапии ‒ составил 66,6 %. Сохранение нормализации биохимического и вирусологического ответа к моменту окончания лечения, то есть полная первичная ремиссия (ППР) зарегистрирована у 70,8 % пациентов. Неполная (биохимическая) первичная ремиссия зафиксирована у одного пациента. Частота полной стабильной ремиссии (ПСР) - сохранение биохимического и вирусологического ответа через 24 недели и более после окончания лечения составила 62,5 % . Среди всех детей, у которых зафиксирована полная стабильная ремиссия, отмечался ранний вирусологический ответ, и регистрировалась полная первичная ремиссия. В то же время при наличии быстрого вирусологического ответа у всех пациентов была достигнута только полная первичная, но не полная стабильная ремиссия, так как у 2 детей, имевших авиремию через 4 недели от начала лечения, наблюдалось ускользание ремиссии через 3 месяца после прекращения курса лечения. Подтверждена зависимость эффективности ПВТ от генотипа HCV. Самый высокий процент ПСР был зарегистрирован при 3а генотипе вируса - 66,7 %, тогда как при 1в генотипе он составил 58,3 %. Немаловажным явилось и то, что в 40,6 % случаев пациенты получали более низкие дозы препаратов по сравнению со стандартной схемой, и видимо именно в связи с этим отмечалось снижение частоты и длительности проявления побочных эффектов ПВТ в противовес общепринятым стандартам дозирования. Хотя гриппоподобный синдром и встречался в 90 %, но его продолжительность не превышала 1‒2 недель, тогда как при стандартных схемах эпизоды гипертермии нами отмечались до 3‒4 недель. Лихорадка хорошо купировалась приемом жаропонижающих средств. Головные боли беспокоили в основном подростков и встречались в 16,6 % случаев. Как и при стандартных схемах, достаточно часто отмечались артралгии - 20,8 %. Аллергическая реакция в виде экзантемы зафиксирована у 1 пациентки, получающей комбинированную схему лечения - А3 + Р800. Данные проявления не требовали отмены препаратов, и терапия была продолжена на фоне приема сорбентов и антигистаминных средств. Аллопеция и снижение веса встречались с одинаковой частотой - 8,3 %. Других побочных эффектов, таких как цитопения, миалгии, широко встречающихся при обычных схемах дозирования, зарегистрировано не было. Таким образом, в ходе индивидуально подобранной ПВТ отклонений, требующих полного прекращения лечения, или редукции дозы препаратов и обострений сопутствующей хронической патологии отмечено не было.
Заключение
В ходе исследования установлено, что у детей, больных ХГВ и С, несмотря на высокую частоту репликации вируса (ХГВ - 80 %, ХГС - 90,2 %), заболевание характеризуется скудной клинической симптоматикой, минимальной биохимической активностью и медленно прогрессирующим характером течения. Доказана корреляция уровня эндогенной интоксикации с длительностью заболевания, что указывает на ее значение в патогенезе хронических вирусных гепатитов у детей. Учитывая, что изменения ВНСММ крови выявлены даже при отсутствии клинических симптомов интоксикации, рекомендовано включение данного исследования в алгоритм обследования больных ХГ для оценки степени эндогенной интоксикации и определения необходимости назначения коррекционной патогенетической терапии. Использование индивидуального способа подбора ПВТ у детей, больных ХГС, основанного на определении тиолсульфидного соотношения, позволило достичь частоты полной первичной и полной стабильной ремиссии до 70,8 и 62,5 % соответственно и снизить регистрацию побочных эффектов в 2 раза.
Список литературы
- Антонова Т.В., Алексеева Е.А., Кутманова А.З., Хасан-Ахуинова А.В. Значение среднемолекулярных пептидов в оценке синдрома интоксикации при инфекционных заболеваниях //Актуальные вопросы войско-морк. и клинической медицины. Сборник материалов научно-практическ. конф. - СПб., 1995. - С. 27-28.
- Большакова Л.В. Значение среднемолекулярных пептидов в характеристике интоксикационного синдрома при вирусных гепатитах: автореф. дис. канд. мед. наук. - СПб., 1997. - 20 с.
- Комиссаров С.Н. Сравнительная клинико-лабораторная и морфологическая характеристика хронических гепатитов С и В с учетом регенераторной способности печени: автореф. дис. канд. мед. наук. - СПб., 2008. - 21 с.
- Патент РФ № 2150700, 10.06.2000.
- Рейзис А.Р. Терапия и профилактика хронических гепатитов В и С у детей и подростков // Современные проблемы профилактической педиатрии: диагностика, лечение и профилактика хронических вирусных гепатитов В, С и D у детей: Сб. - М., 2003. - С. 6-8.
- Шахгильдян И.В., Михайлов М. И., Онищенко Г.Г. Парентеральные вирусные гепатиты (эпидемиология, диагностика, профилактика). - М.: ГОУ ВУНМЦ МЗ РФ, 2003. - С. 384.
Рецензенты:
Романцов М.Г., д.м.н., профессор кафедры инфекционных болезней СПбГМА им. И.И. Мечникова и кафедры педиатрии СПбГМАПО, Санкт-Петербург;
Эсауленко Е.В., д.м.н., профессор, зав. отделением экспериментальной терапии хронических вирусных гепатитов ФГУ НИИ Гриппа МЗ и социального развития РФ, Санкт-Петербург.



