В последние годы не угасает интерес к эпидемиологии стафилококков как этиологических агентов многих инфекционных заболеваний, поcкольку стафилококковое бактерионосительство служит причиной формирования серьезных осложнений в условиях госпитализации.
Особую актуальность этот вопрос приобретает в связи с широким распространением и циркуляцией как в природной популяции, так и госпитальной среде метициллинрезистентных штаммов золотистого стафилококка (MRSA). Принципиально важным для дифференциации таких штаммов является исследование генных комплексов, входящих в состав стафилококковых хромосомных кассет mec (staphylococcal chromosome cassette mec, SCCmec), а также определение генов, детерминирующих синтез энтеротоксинов A, B, C и др., токсина синдрома токсического шока (TSST).
Проведенные некоторыми авторами исследования выявили, что S. aureus принадлежит к гетерогенным и полиморфным видам, у которых не только гены антибиотикорезистентности, но и многие гены патогенности присутствуют в хромосоме в составе геномных островов различных типов: островов «патогенности», стафилококковых хромосомных кассет (SCC), профагов. В разных штаммах эти генетические элементы характеризуются различной степенью мобильности. Генетическое разнообразие внутри вида является следствием горизонтального переноса генов, расположенных на мобильных генетических элементах (МГЭ).
Для большинства стафилококков естественной средой обитания является поверхность кожи человека, слизистые, где они персистируют, не причиняя вред организму хозяина. Однако, как показывают работы последних лет [1, 3], при хронических дерматозах происходят изменения микробиоценозов кожи, в частности, возрастает степень обсемененности кожи представителями рода Staphylococcus, особенно S.aureus. В этой связи встает вопрос об этиопатогенетической роли этих бактерий в развитии кожных патологий. Поскольку основными поражающими факторами воздействия стафилококков на эукариотические клетки и ткани являются секретируемые факторы вирулентности и патогенности (токсины), целью настоящей работы явилось исследование вариабельности геномных комплексов стафилококков, выделенных с кожи людей при хронических дерматозах.
Материал и методы исследования
Бактериальные штаммы. В работе были использованы 185 штаммов стафилококков, из них – 91 штамм S. aureus (49,1 %), полученные от лиц в возрасте от 18 до 80 лет, находящихся в стационаре областного кожно-венерологического диспансера г. Ульяновска с хроническими дерматозами: псориаз (57/144, 39,6 %), экзема (68/144, 47,2 %), атопический дерматит (19/144, 13,2 %).
Забор материала осуществляли с пораженных и интактных участков кожи ватным тампоном, смоченным 0,85 % раствором хлористого натрия. Смывы в количестве 0,1 мл засевали на селективные питательные среды, через 48 часов подсчитывали количество выросших колоний и пересчитывали на 1 см2 кожи (Иванов, 1984). Результаты пересчитывали на КОЕ/см2. Первичную родовую и видовую идентификацию стафилококков осуществляли на основании морфологии колоний, окраски по Граму, данных каталазного и коагулазного тестов. Качественное и количественное исследование микробиоценозов кожи осуществляли на базе бактериологической лаборатории городской клинической больницы № 1 г. Ульяновска (зав. лабораторией – Волгина Т.И.). Полученные данные подвергали статистической обработке с использованием пакета прикладных программ Microsoft Еxcel 2003.
Видовая идентификация стафилококков прямым масс-спектрометрическим профилированием. Свежие бактериальные клетки (1–2 колонии) переносили в 300 мкл деионизированной воды, перемешивали и добавляли 900 мкл этанола. Осадок после центрифугирования (15 мин×14000 об/мин) растворяли в 20 мкл смеси 50 % ацетонитрила (АЦН), 35 % муравьиной кислоты. Полученный в результате последующего центрифугирования супернатант анализировали времяпролетной МАЛДИ масс-спектрометрией. Все использованные реактивы, включая воду, были аналитической чистоты или специальные для масс-спектрометрии.
В качестве матрицы применяли a-циано-4-гидроксикоричную кислоту (a-cyano-4-hydroxycinnamic acid, a-CHCA, BrukerDaltonics, Германия) в виде насыщенного раствора в смеси 50 % АЦН, 2,5 % трифторуксусной кислоты (ТФУ). Для сокристаллизации матрицы и образца 1 мкл аналита наносили на ячейки стальной мишени для масс-спектрометрии (MSP 96 target ground steel, BrukerDaltonics, Германия), давали подсохнуть 1–2 минуты и сверху наслаивали 2 мкл насыщенного раствора матрицы. Кристаллы оставляли на воздухе в течение 5–10 мин до полного высыхания. Влажность и температуру при этом не контролировали.Масс-спектрометрический анализ осуществляли с помощью времяпролетного МАЛДИ масс-спектрометра MicroflexTM (BrukerDaltonics, Германия), оснащенного азотным лазером 337 нм. Все измерения проводили в линейном режиме, детектируя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образца. Параметры масс-спектрометра оптимизировали для диапазона m/z от 2000 до 20000. Внешнюю калибровку проводили с использованием точных значений масс известных белков E. coli.
Для записи, обработки и анализа масс-спектров использовали программное обеспечение компании Bruker Daltonics (Германия): flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11). Точность измерения масс составляла ± 2 Да. Видовую идентификацию бактерий проводили путем сопоставления получаемых масс-спектров с имеющимися базами данных с помощью программного пакета MALDI Biotyper 2.0 (Bruker Daltonics, Германия).
Генетическое тестирование стафилококков
Выделение геномной ДНК стафилококков проводили с использованием набора «Политуб» (ТУ-9398-410-17253567-97) (ООО НПФ Литех, Россия) в соответствии с прилагаемыми инструкциями. Для типирования стафилококковой хромосомной кассеты mec применяли мультипраймерную ПЦР с использованием праймеров к mec комплексу и ccr комплексу. Праймеры и условия реакций были описаны ранее [5, 6, 7, 8, 9, 10].
Для установления наличия генов, детерминирующих синтез стафилококковых энтеротоксинов (гены sea – sed, sei – sej), токсина синдрома токсического шока (ген tsst) и лейкоцидина (гены lukS – lukF) применена традиционная ПЦР с использованием предложенных ранее праймеров [9, 10].
Амплификацию исследуемых фрагментов ДНК выполняли в реакционной смеси, содержащей 10 мМ Tris-HCl, pH 9,0; 50 мM KCl; 2 мM MgCl2, по 250 мкМ каждого дНТФ, 1 едTaq-полимеразы (Promega, USA) и по 10 пмоль каждого праймера в объеме 25 мкл. Реакцию амплификации проводили в программируемом термостате DNA EngineTetrad 2 (MJ Research, USA), используя следующий профиль амплификации: 94 °С – 5 мин., 30 циклов: 94 °С – 1 мин, 60 °С – 1 мин, 72 °С – 1 мин. Продукты реакции анализировали в 2 % агарозном геле.
Результаты исследования и их обсуждение
Согласно данным бактериологического и масс-спектрометрического тестирования установлен видовой состав стафилококков, выделяемых от пациентов с дерматитами. Среди проанализированных 185 штаммов, 91 штамм (49,1 %) принадлежал к виду S. aureus, 28 штаммов (15,1 %) – к S. epidermidis, 30 штаммов (16,2 %) составили S. hominis, 18 (9,7 %) штаммов – S. haemolyticus, S. capitis– 4 (2 %), на такие виды как S. saprophyticus, S. warneri, S. pattenkoferi приходилось по 0,5 %. Также результаты генетического типирования показали наличие среди выделенных штаммов Micrococcus luteus и Corynebacteriumaurim ucosum в 0,5 % случаев.
Исследуемые штаммы продемонстрировали наличие гена mecA в 15 случаях из 185 (8,1 %), причем данный признак был обнаружен только среди коагулазоотрицательных стафилококков: S. hominis – 7 штаммов из 30 (23,3 %); S. epidermidis – 4 штамма из 28 (14,3 %); S. haemolyticus – 4 штамма из 18 (22,2 %).
Наличие стафилококковой хромосомной кассеты SCCmec у коагулазоотрицательных стафилококков, по мнению некоторых авторов [4], свидетельствует о ее участии в функции горизонтального обмена генами. Считается, что первыми стафилококками, получившими SCCmec, были S. haemolyticus, и только в последующем произошла передача этого элемента другим коагулазоотрицательным стафилококкам и S. aureus [2].
Полученные результаты по отсутствию гена mecA среди изученных штаммов S. aureus согласуются с данными литературы. Cобранные нами штаммы относятся к внебольничной популяции стафилокококков, среди которых процент устойчивых к метициллину штаммов составляет не более 30 %, тогда как ген mecA, кодирующий устойчивость к метициллину, обнаруживается преимущественно среди госпитальных стафилококков – до 40 %.
С учётом значительной разницы в уровне сочетанной устойчивости у MSSA и MRSA необходимо отдельно наблюдать за динамикой резистентности этих популяций, чтобы избежать ошибочных выводов о «нарастании резистентности» к широкому спектру антибиотиков среди всех штаммов S. аureus.
Следующую группу молекулярных маркеров составили расположенные на МГЭ гены, детерминирующие синтез энтеротоксинов A, B, C и др., токсина синдрома токсического шока, т.е. те гены, продукты которых обладают суперантигенной активностью (PTSAgs) и могут оказать влияние на состояние иммунореактивности макроорганизма. Определение наличия генов PTSAgs позволяет выявить патогенный потенциал и охарактеризовать отдельные штаммы. Проведенные исследования показали наличие генов, детерминирующих токсинообразование стафилококков у 40,5 % изученных штаммов (75 клинических изолятов). Следует отметить, что частота встречаемости указанных генов у штаммов золотистого стафилококка составила 86,7 %, у коагулозоотрицательных штаммов – 13,3 % случаев.
Обнаружена значительная вариабельность в наборе генов, детерминирующих синтез этих токсинов у клинических изолятов стафилококков. Так, изученные штаммы имели от одного до четырех генов в различных сочетаниях. В геноме 35 изолятов обнаружен только один ген из sea – sei. У 20 штаммов преобладали по два гена и у 20 – от трех до четырех генов. При этом установлено, что коагулазоотрицательные штаммы, несущие mec A, не обладали ни одним из перечисленных генов. В целом из общего количества генетических детерминант токсинообразования преобладали гены seg – 26,8 %, seh – 17,1 % случаев.
Исходя из значительной видовой вариабельности грамположительной флоры в микробиоценозе кожи исследуемых больных, была проанализирована частота встречаемости генов, определяющих токсинообразование стафилококков в зависимости от видовой принадлежности штаммов.
Так, наибольшим разнообразием генов обладали штаммы золотистого стафилококка, среди которых преобладал ген seg. В связи с тем, что среди коагулазоотрицательных штаммов стафилококков наибольшую частоту встречаемости показали гемолитический и эпидермальный стафилококки, а доля остальных оказалась незначительна, то анализ генов, детерминирующих токсинообразование, осуществляли только у этих видов стафилококков, что показало у S. haemolyticus наличие только генов seb и sed, у эпидермального стафилококка только seh.
Значительный интерес представлял анализ полученных результатов в зависимости от участка кожи, с которого были выделены микроорганизмы. В соответствии с этим все полученные штаммы разделили на две группы: 1-я – штаммы, выделенные с чистых участков кожи, 2-я – штаммы, выделенные с пораженных участков кожи (рис. 1).
Таким образом, наиболее значимые различия по частоте встречаемости детерминант токсинообразования можно отметить для генов sea (14,7 % в 1-й группе и 7,3 % во 2-й) и sei (11,7 % в первой группе, 19,1 % – во второй). Причем ген sea достоверно чаще обнаруживался в стафилококках, изолированных на чистых участках кожи, тогда как ген sei – на пораженных. Частота встречаемости данного признака в указанных группах в зависимости от вида микроорганизмов показала различия только для S. aureus (рис. 2). Для остальных видов из рода Staphylococcus, наиболее часто обнаруживаемых на коже, результаты следующие: S. epidermidis показал ген энтеротоксина sei в одном случае с чистого участка кожи. А S. haemolyticus – наличие 1 случая из двух, наличие гена sed – в одном из четырех случаев.
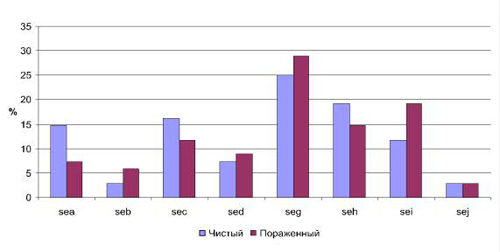
Рис. 1. Частота встречаемости энтеротоксинов a, b, c, d, g, h, I, j в зависимости от участка кожи
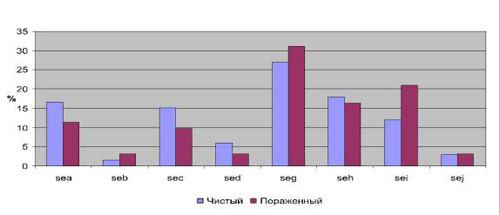
Рис. 2.Частота встречаемости детерминант токсинообразования у S. aureus, выделенных с чистого и пораженного участка кожи
Ген TSST обнаружен только в 10,8 % случаев от всего количества исследуемых штаммов, причем в двух случаях параллельно с наличием хромосомной кассеты mecA у S. epidermidis. При этом в 55 % случаев ген TSST обнаруживали у штаммов, выделенных с чистых участков кожи, в 45 % случаев – с пораженных участков.
Выводы
Сравнительный анализ хромосомной ДНК стафилококков, выделенных при хронических кожных патологиях, показал, что изученные штаммы Staphylococcus spp. обнаруживают значительную вариабельность в наборе генетических детерминант, характеризующих их патогенный потенциал.
Кассета mecA, рассматриваемая как фактор устойчивости к метициллину, была обнаружена в 8,1 % случаев и только среди коагулазоотрицательных стафилококков.
Гены токсинообразования наиболее часто встречались среди коагулазоположительных стафилококков (S. aureus). Наиболее часто в проанализированной выборке встречались гены seg – 26,8 %, и seh – 17,1 % случаев.
Штаммы, изолированные с разных участков кожи, значимо отличались по частоте обнаружения маркеров генов энтеротоксинов A, С и I.
Таким образом, молекулярно-генетический анализ ДНК и генотипирование стафилококков может иметь теоретическое и практическое значение в целях обеспечения более качественной диагностики стафилококковой инфекции, эффективного мониторинга и лечения.
Рецензенты:
Нестеров А.С., д.м.н., профессор, зав. Циклом кожных и венерических болезней кафедры инфекционных и кожно-венерических болезней медицинского факультета Ульяновского государственного университета, г. Ульяновск;
Ильина Н.А., д.б.н., первый проректор, проректор по научной работе, профессор, ФГБОУ «Ульяновский государственный педагогический университет им. И.Н. Ульянова», г. Ульяновск.
Работа поступила в редакцию 30.08.2012.



