Род Quercus L. насчитывает около 500 видов, из них на территории России наибольшее распространение имеет дуб черешчатый – Quercus robur (или летний, или обыкновенный, или английский), поскольку он хорошо адаптируется к разным почвам и климатическим условиям.
У дуба встречаются две фенологические формы: рано- и позднораспускающиеся деревья, различающиеся не только по времени цветения, но и по хозяйственной ценности. Эти формы наследуются, что имеет большое значение для селекции. В известных дубравных массивах ЦЧР – Теллермановской ооще и Шиповой дубраве – по площади преобладают деревья поздней формы, которая является более ценной по продуктивности и качеству стволовой древесины. При отборе по этим параметрам деревья разделяют на три селекционные категории: плюсовые (наилучшие), нормальные (хорошие и средние), минусовые (плохие). Основное селекционное значение имеют плюсовые деревья, используемые как маточно-семенные деревья для сбора семян и заготовки черенков для закладки лесосеменных плантаций (ЛСП) [1]. Одной из проблем при размножении дубов является затрудненность определения генетической ценности плюсовых деревьев и их семенного потомства. Поэтому целью работы было выяснение биохимических особенностей метаболизма плюсовых деревьев дуба черешчатого в сравнении с контрольными деревьями этой породы.
Материалы и методы исследования
Объектами исследования служили плюсовые по форме ствола деревья дуба черешчатого: 10 деревьев, произрастающие в Семилукском питомнике (клоновые культуры, ЛСП, возраст привоев со 140-летних плюсовых деревьев – 20 лет, закладка 1982 года, автор – Ю.П. Ефимов). В качестве контроля использованы произвольно отобранные (не плюсовые) деревья позднораспускающейся формы, также растущие на территории Семилукского питомника.
В качестве биологического материала, используемого для изучения активности и электрофоретических анализов, были взяты почки, находящиеся на стадии глубокого покоя, распускающиеся почки и ювенильные листья. Ферментативный препарат получали центрифугированием в течение 7 мин при 4200 g растертых со стеклом листьев в 0,1 М трис-НС1 буфере, рН 7,5, содержащем 5 % поливинилпирролидона (ПВП). Все работы проводили на холоде. За единицу ферментативной активности принимали количество фермента, катализирующее образование 1 мкМ продукта за 1 мин при 25 °С с учетом коэффициента молярной экстинкции («общая активность», ФЕ/мл). Удельную активность рассчитывали, относя общую активность на 1 мг белка (ФЕ/мг). Надосадочные жидкости в процессе работы сохраняли в эппендорфах в твердотельном термостате BIOSAN CH-100 при –3 °С.
Активность ферментов определяли по Землянухину А.А. и Землянухиной О.А. [2,3]. Измерение оптической плотности проводили в 1 см кварцевых кюветах на СФ-102 в течение 3–15 мин. Выбор ферментов обусловлен их принадлежностью к основным метаболическим циклам клетки.
Изоферментный анализ проводили электрофоретически по стандартному методу Дэвиса в вертикальных пластинах ПААГ в камере конструкции К.А. Трувеллера и Г.Н. Нефедова (1974). Одновременно использовали две гелевых пластины, электрофорез проводили в морозильной камере холодильника (–20 °С) при постоянном токе 40 mA в течение 4 часов. Выявление изоферментного спектра энзимов проводили по руководствам Левитаса [5] и Soltis [11]. Количественное содержание белка выполнено по методу Брэдфорда [8].
Результаты исследования и их обсуждение
Активность ферментов – эпигенетический показатель состояния дерева, его индивидуальной изменчивости. Часто разница между отдельными особями видна не на белковых/ энзиматических профилях, но выявляется на уровне активности ферментов. Так как активность ферментов меняется в течение онтогенеза – будь то лист или целое дерево – в наши задачи входило также установить, в какие временные отрезки необходимо осуществлять отбор материала для биохимического анализа. Материалы работы содержат описание наиболее информативных ферментов, проявивших отличия у исследуемых деревьев дуба.
Первые измерения активности ферментов были сделаны в феврале 2012 г. Анализ показал, что в зимних почках дуба, с которых предварительно были сняты почечные чешуи и оставлена зеленая середина, обнаруживается активность только одного энзима – пероксидазы (ПО; КФ 1.11.1.7). При этом активность фермента колеблется от 0,35 ФЕ/мг (дерево № 44) до 3.02 (№ 42). По мере разворачивания листьев снижается количество белка, растет удельная активность (таблица).
Общая и удельная активности пероксидазы (10.04.12)
|
Дерево, № (К – контроль) |
Общая активность, ФЕ/мл |
Удельная активность, ФЕ/мг |
|
К1 |
12,48 ± 0,54 |
13,00 ± 0,62 |
|
К2 |
16,50 ± 0,27 |
15,87 ± 0,72 |
|
К3 |
28,30 ± 1,12 |
39,86 ± 1,02 |
|
К4 |
16,55 ± 0,75 |
20,95 ± 0,98 |
|
К5 |
16,53 ± 0,26 |
17,04 ± 0,79 |
|
6 |
9,70 ± 0,47 |
16,17 ± 0,65 |
|
26 |
10,33 ± 0,39 |
14,76 ± 0,63 |
|
29 |
8,90 ± 0,16 |
13,09 ± 0,57 |
|
42 |
11,05 ± 0,51 |
12,42 ± 0,60 |
|
43 |
16,18 ± 0,82 |
25,68 ± 1,12 |
|
44 |
11,08 ± 0,64 |
17,59 ± 0,81 |
|
96 |
16,25 ± 0,59 |
18,26 ± 0,86 |
|
125 |
10,90 ± 0,37 |
13,13 ± 0,34 |
|
129 |
12,73 ± 0,66 |
13,69 ± 0,48 |
|
138 |
16,18 ± 71 |
33,71 ± 1,23 |
Увеличение активности ПО в листьях совпадает с изменениями в изоферментных спектрах фермента. Так, если в феврале спектры деревьев идентичны и представлены 5 зонами, то в третьей декаде марта спектр представлен 13, а еще через две недели – 19 формами энзима (рисунок).
Дополнительно проведенные электрофоретические исследования выявили на стадии глубокого покоя активность таких ферментов, как супероксиддисмутаза, цитохром-с-оксидаза, шикимат- и алкогольдегидрогеназы. И если АДГ в спящих почках выявила только одну зону активности, то к началу мая спектр расширился до 5 изоформ.
Фермент цитохром-с-оксидаза (КФ 1.9.3.1) является отдельным звеном дыхательного метаболизма клетки. Он вносит существенный вклад в образование макроэргических соединений помимо фотосинтеза за счет митохондриального дыхания. Этот фермент обнаружен наряду с пероксидазой в почках на стадии глубокого покоя (первая декада февраля). Средняя удельная активность цитохром-с-оксидазы в митохондриальном экстракте у контрольных деревьев составляет 30,08 ФЕ/мг, а у опытных плюсовых – 72,62 ФЕ/мг. Возможно, плюсовые деревья обладают более мощным биоэнергетическим потенциалом, создающим в клетке благоприятные метаболические условия.
а) 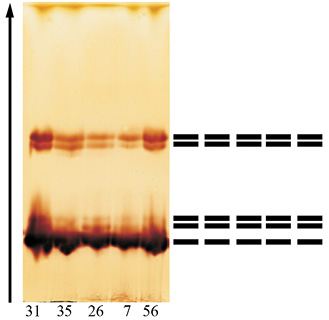 б)
б) 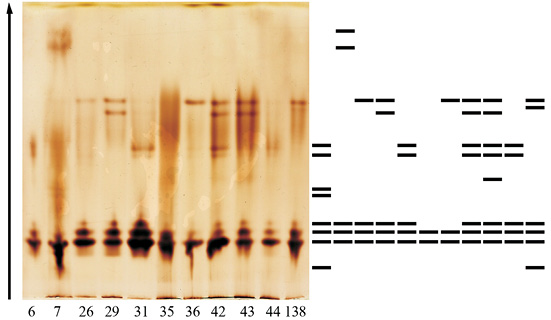
Изоформы ПО дуба черешчатого:а – в зимних почках (28.02.12); б – в ювенильных листьях (26.03.12)
Изоферментный спектр цитохром-с-оксидазы в митохондриальном экстракте в феврале насчитывал 9 зон активности, а к апрелю происходит его редуцирование до 7 полос. Плюсовые деревья показывают более ровный характер рисунка активности в листьях по сравнению с контрольными деревьями. Фермент отражает дыхательные процессы в митохондриях и скорее связан не с генетическими параметрами, а с индивидуальной энергетикой деревьев.
Фермент супероксиддисмутаза (КФ 1.15.1.1) относится, как и ПО, к ферментам, изменяющим свою активность при изменении условий окружающей среды. Наличие в спящих почках ферментов, связанных с разрушением избыточных количеств активных форм кислорода, – перокидазы, супероксиддисмутазы и других, объясняется тем, что в условиях глубокого покоя в клетках не функционируют или функционируют на низком уровне такие основные метаболические пути, как цикл трикарбоновых кислот, глиоксилатный цикл и другие [7]. Хотя изоформы СОД и отличаются у некоторых деревьев, вклада в генетическую изменчивость они не вносят.
Фермент эстераза (КФ 3.1.1.1) локализуется главным образом в лизосомах цитоплазмы клеток. Изоферментный анализ неспецифической эстеразы используют для определения сортов, гибридов, уточнения классификации и т.д. [6]. И хотя активность фермента не выявила специфичности отдельных деревьев выборки, тем не менее изоферментный спектр имеет выраженные отличия между деревьями.
Начиная с марта 2012 года, были измерены активности еще целого ряда ферментов. Одним из первых анализировали NADH-дегидрогеназу (КФ 1.6.99.1). Ее часто называют альтернативная оксидаза, она связана с выделением части ассимилированного СО2. Известно, что получение трансгенных растений, дефицитных по альтернативной оксидазе (NADH-дегидрогеназе), показывает снижение как жизнеспособности, так и продуктивности растений [10]. В молодых листьях активность NADH-дегидрогеназы повышается и достигает у дерева № 96 значения 327,76 ФЕ/мг. Среднее значение активности фермента у контрольных деревьев составляет 121,10∙10–3 ФЕ/мг, а у плюсовых деревьев – 203,03 ФЕ/мг соответственно. Возможно, это говорит об усилении дыхания, связанного с митохондриями, и особенно активно этот процесс происходит у плюсовых деревьев. Вероятно, генетические особенности плюсовых деревьев могут влиять на эпигенетические показатели, в том числе и на активность ферментов.
Активность малик энзима (КФ 1.1.1.39) обнаруживается главным образом в растительных клетках и имеет митохондриальную локализацию, хотя она встречается и в цитоплазме [9]. Энзим проявляется во всех тканях, где протекают энергетические и биосинтетические процессы. Кроме того, МЭ обеспечивает также протекание обходного пути окисления малата в тех условиях, когда оксидоредуктазная дегидрогеназа (МДГ; КФ 1.1.1.37) внутри митохондрий блокируется тем или иным образом. Результаты работы показали, что активность МДГ остается на уровне нуля в течение двух месяцев, от спящей почки до распускания листьев. Активность малик-энзима в зимних почках у некоторых плюсовых деревьев дуба также падает до нуля, а у деревьев № № 29, 43, 44 остается на нулевом уровне на протяжении всего периода измерения. Возможно, это может объясняться переходом растений к нормальному фотосинтезу. В это же время максимальная активность фермента у контрольных деревьев достигает значения 81,25 ФЕ/мг (д.К4) и 59,47 ФЕ/мг (д.К5), среднее значение активности у контрольных деревьев составляет 42,15 ФЕ/мг, а у опытных плюсовых деревьев – 4,61 ФЕ/мг белка.
NADP-изоцитратдегидрогеназа, субстратом которой является изоцитрат (КФ 1.1.1.42), практически не проявляет активность в зимних почках дуба. Однако ее активность возрастает на 1–2 порядка в распустившихся листьях, когда активно начинает функционировать ЦТК. Средние значения удельной активности у опытных деревьев превышают показатели контрольных деревьев более чем в 1,5 раза. Другим ферментом, субстратом которого является изоцитрат, является изоцитратлиаза (КФ 4.1.3.1). Этот фермент является ключевым в функционировании глиоксилатного цикла – альтернативного циклу трикарбоновых кислот, представителями которого являются ИДГ и малатдегидрогеназы. Результаты измерений показали, что активность фермента медленно уменьшается в ходе раскрывания почки, увеличиваясь в ювенильных листьях, что, по-видимому, связано с уменьшением белка в тканях. Удельная активность ИЦЛ контрольных деревьев в среднем в 1,72 раза превышает таковую у опытных. Это значит, что активность фермента генетически детерминирована и в некоторых случаях, наряду с изоферментными спектрами, может служить идентификатором дерева.
В ходе работы были определены активности ещё нескольких энзимов: лакказы (КФ 1.14.18.1), щелочной фосфатазы (КФ 3.1.3.1), кислой фосфатазы (КФ 3.1.3.2), АТФ-азы (КФ 3.6.1.3) и 6-фосфофруктокиназы (КФ 2.7.1.11). Нами впервые показано наличие активности лакказы (полифенолоксидазы) в листьях дуба. Энзим стабилен в течение нескольких дней даже без добавления стабилизирующих агентов (сахарозы, глицерина и пр.). Установлено, что проявление активности лакказы зависит от природы буфера и возрастает в следующем ряду в реакции окисления АБТС: ацетатный (рН 3,6–5,5), цитратный (рН 4,5–5,5), буфер Мак-Ильвейна (рН 4,0–5,0). Активность фермента в последнем в 12 раз превышает его проявление в других буферных системах; это действие высокоспецифично и отличается от простой активации фермента ионами фосфора [4]. Средняя активность фермента у контрольных деревьев составляет 0,66 ФЕ/мг, а у плюсовых – 0,41 ФЕ/мг.
Щелочная фосфатаза – гидролитический фермент, осуществляющий дефосфорилирование многих типов молекул (нуклеотидов, белков и алкалоидов и др.). Среднее значение активности у контрольных деревьев равно 0,30 ФЕ/мг, а у плюсовых деревьев – 0,44 ФЕ/мг, что также косвенно указывает на больший энергетический потенциал опытных деревьев дуба черешчатого.
Последней была измерена активность 6-фосфофруктокиназы, входящей в мультиферментный комплекс ключевых ферментов – глюкозо-6-фосфатдегидрогеназы, 6-фосфофруктокиназы, цитохром-с-оксидазы – отдельных звеньев дыхательного метаболизма клетки (пентозофосфатный путь, гликолиз и электрон-транспортная цепь митохондрий). Данный энзим показал примерно одинаковые значения активности у всех изученных деревьев.
Заключение
Проведенный анализ активности ферментов выявил сходства и различия между отдельными деревьями как в контрольных, так и в опытных группах. Такие ферменты, как пероксидаза, глюкозо-6-фосфатдегидрогеназа, неспецифическая эстераза, кислая фосфатаза, АТФ-аза, 6-фосфофруктокиназа обнаружили примерно одинаковую активность у всех тестируемых деревьев. Активность МДГ на протяжении всего периода измерения (2 месяца) не промерялась. Остальные ферменты можно подразделить на две группы: в первой группе активность ферментов плюсовых деревьев превышает активность соответствующих ферментов контрольных деревьев, а во второй – наоборот. К первой группе относятся NADH-ДГ, ИДГ, цитохром-с-оксидаза и щелочная фосфатаза, ко второй – ИЦЛ, МЭ и лакказа. Величины среднеквадратичных отклонений у некоторых из них перекрываются, поэтому можно говорить только о тенденции превышения или понижения активности. Тем не менее, эта тенденция особенно заметна на примере малик энзима, где среднее значение активности у плюсовых деревьев составляет 42,15 ФЕ/мг, а у контрольных – 4,61 ФЕ/мг белка. Ферменты, выделяемые нами в две группы, имеют преимущественно митохондриальную локализацию (за исключением щелочной фосфатазы, являющейся мембраносвязанным ферментом). Думается, что это не случайно, потому что митохондрии являются «энергетическими станциями», обеспечивающими клетки энергией, необходимой для их функционирования, в их матриксе содержатся ДНК, рибосомы, ферменты цикла Кребса, окисления, а также ферменты, обеспечивающие синтез белков и репликацию генетического материала митохондрий. Действие фермента лакказы у растений связано с процессом синтеза лигнина, который присутствует у всех древесных растений. Для получения результатов с бóльшей достоверностью необходимо увеличить выборку деревьев как контрольных, так и опытных, возможно, с большего участка произрастания дуба.
Предлагаемый нами набор изоферментов для дуба черешчатого в полиакриламидном геле при условии использования зимних почек и проведении электрофореза при –20 °С следующий: алкогольдегидрогеназа, глутаматдегидрогеназа, формиатдегидрогеназа, эстераза, лейцинаминопептидаза.
Результаты проведенной работы показали, что на стадии глубокого покоя действуют только некоторые ферменты – перокидаза, супероксиддисмутаза, цитохром-с-оксидаза, эстераза и некоторые другие. Это объясняется тем, что в условиях глубокого покоя в клетках не функционируют или функционируют на низком уровне такие основные метаболические пути, как цикл трикарбоновых кислот, глиоксилатный цикл и другие. Активность фермента в свою очередь обусловлена экспрессией гена, ответственного за синтез энзима. Вероятно, генетические особенности плюсовых деревьев могут влиять на эпигенетические показатели, в том числе и на активность ферментов. Для подтверждения этой гипотезы необходимо оценить уровень эндогенных регуляторов роста у опытных и контрольных деревьев, а также измерить степень метилирования их ДНК.
Данная работа является первой, посвященной метаболизму плюсовых деревьев дуба. На основе изучения активности ферментов в почках и листьях можно делать предварительные выводы о будущей энергетике дерева, форме его ствола.
Рецензенты:
Свистова И.Д., д.б.н., профессор кафедры биологии растений и животных естественно-географического факультета ФГБОУ ВПО «Воронежский государственный педагогический университет», г. Воронеж;
Мелькумова Е.А., д.б.н., профессор кафедры ботаники, защиты растений, биохимии, микробиологии ФГБОУ ВПО «Воронежский государственный аграрный университет имени императора Петра I», г. Воронеж.
Работа поступила в редакцию 28.12.1012.



