Пшеница является основной зерновой культурой для 35 % населения земного шара, под посевами которой занято 216 млн га. Исследование генетического разнообразия сортов пшеницы мягкой (Triticum aestivum L.) может предоставить существенную информацию относительно ее потенциала в селекционных целях [11]. Ежегодно селекционными учреждениями создаются и передаются для коммерческого использования сотни новых сортов. Из-за ограниченного количества родительских ресурсов в размножении число подобных сортов пшеницы быстро растет, что приводит к перекрыванию сортов на рынке семян. С увеличением числа новых подобных или тесно связанных сортов пшеницы все более важным становится процесс регистрации культурного сорта, его сертификации и защиты авторских прав селекционеров [14]. Генетическая идентификация и паспортизация различных линий и сортов позволяют также избежать и нелегального распространения перспективного селекционного материала.
Генетическая паспортизация представляет собой метод получения генетически детерминированных характеристик с помощью морфологических или молекулярных маркеров. На сегодняшний день проведение генетической паспортизации считается актуальной задачей современной селекции. В мировой практике для индивидуальной паспортизации объектов лесного и сельского хозяйства используют преимущественно ДНК-маркеры [4]. Молекулярные маркеры отличаются высоким уровнем полиморфизма между сортами и могут эффективно использоваться для оценки общих генетических характеристик [11].
Для исследований межсортового полиморфизма, выявления генетического сходства/отдаленности генотипов разных сортов пшеницы с целью их дифференциации и паспортизации нами был избран ISSR-метод (Inter Simple Sequence Repeat [15]). В настоящее время ISSR-метод широко используется при выявлении внутривидового полиморфизма, в первую очередь у близкородственных генотипов культивируемых растений [3]. При ISSR-PCR анализе микросателлитные последовательности используются в качестве праймеров в полимеразной цепной реакции для создания мультилокусных спектров. ISSR-маркеры полиморфны и могут быть использованы в исследованиях генетического разнообразия, филогении, молекулярном маркировании геномов хлебных злаков. Используемые ISSR-праймеры могут быть ди-, три-, тетра- или пентануклеотидными мотивами микросателлитов, давая огромное количество возможных продуктов амплификации.
Идентификация сортов пшеницы мягкой с высоким адаптивным потенциалом является актуальной задачей для Урала, климат которого характеризуется холодной продолжительной и снежной зимой, теплым коротким летом и ярко выраженными температурными инверсиями [7].
Цель нашего исследования – молекулярно-генетическое маркирование и идентификация перспективных для Урала сортов T. aestivum с использованием ISSR-метода анализа полиморфизма ДНК.
Материалы и методы исследования
Материалом для исследования служили свежие листья 26 перспективных для возделывания на Урале сортов пшеницы мягкой: Московская 39, Волжская К, Иргина, Ирень, Стрела, Красноуфимская 100, Свеча, Горноуральская, Терция, Экада 70, Экада 109, Штру 05, Штру 06, Икар, Баженка, Гамлет, Диаблон, Терси, Уралосибирская, Ярица, Красноуфимская 110, Башкирская 4, Башкирская 26, Башкирская 28, Жница и Фотос. Семена сортов были получены из ГНУ «Пермский научно-исследовательский институт сельского хозяйства» РАСХН (г. Пермь), Ординского и Березовского сортоучастков ГСУ Пермского края и ГНУ «Башкирский научно-исследовательский институт сельского хозяйства» (г. Уфа). Для сортов, выращиваемых в Пермском крае, относящемся к зоне рискованного земледелия из-за укороченного вегетационного периода [7], необходимыми качествами сортов являются устойчивость к засухе и раннее созревание, а для сортов, возделываемых в соседнем регионе (республике Башкортостан), для которого характерны резкие колебания температуры в течение суток и сильная дифференциация в распределении осадков на территории, – устойчивость к заморозкам и засухе.
Выделение ДНК проводили из проростков 26 сортов пшеницы мягкой в 2010–2012 гг. по методике А. Торреса соавторами [12]. Навеска свежих листьев составляла 100 мг. Концентрацию и спектральные характеристики ДНК определяли на приборе SpectrofotometrTM NanoDrop 2000 («Thermo scientific», USA). Геномная ДНК была разбавлена до концентрации 10 нг/мкл в TE-буфере. Молекулярно-генетический анализ проведен с использованием ISSR-метода анализа полиморфизма ДНК. Амплификацию ДНК проводили в термоциклере Gene Amp PCR System 9700 («Applied Biosystems», США) по типичной для ISSR-метода программе [6]. Подбор ISSR-праймеров был произведен по эффективности выявления полиморфизма ДНК, рассчитанной в соответствии со шкалой 1–5: от низкой (1) до высокой (5) [5]. Температура отжига для каждого праймера высчитывалась отдельно [6]. Продукты амплификации разделяли электрофорезом в 2 %-м агарозном геле. Для определения длины фрагментов ДНК использовали маркер молекулярной массы (100 bp + 1,5 + 3 Кb DNA Ladder) (ООО «СибЭнзим-М», Москва).
Компьютерный анализ молекулярно-генетического полиморфизма ДНК проведен с помощью специализированного макроса GenAlEx6 для MS-Excel с определением доли полиморфных локусов [13] при Р95. Для ISSR-анализа сортов были рассчитаны матрицы бинарных признаков. Генетическое расстояние (D) между сортами определено по формуле M. Нея и В. Ли [10]. На основе матриц бинарных признаков были рассчитаны матрицы генетических различий [9]. По матрице генетических различий невзвешенным парно-групповым методом (UPGMA – unweighed pair-grup method using arithmetic average) была построена дендрограмма, отражающая степень родства исследуемых сортов по ISSR-спектрам при помощи компьютерных программ Treecon 1.3b и POPGENE 1.32.
Результаты исследований и их обсуждение
Каждый праймер индивидуально был проанализирован в ISSR-ПЦР с геномной ДНК T. aestivum. Нами протестировано 23 ISSR-праймера (табл. 1), из которых для дальнейшего анализа отобраны 5 наиболее информативных, то есть дающих четкие и строго воспроизводимые в повторных ПЦР ISSR-маркеры.
Для выявления сортовых различий и составления генетических паспортов для каждого сорта пшеницы мягкой была проведена ПЦР с каждым из 5 информативных ISSR-праймеров. На основании полученных спектров ампликонов были составлены матрицы, отражающие наличие или отсутствие соответствующего ампликона, характерного для каждого из праймеров (наличие ампликона обозначалось цифрой 1, отсутствие – цифрой 0). У всех изученных 26 сортов T. aestivum наличие или отсутствие ампликонов показано в качестве примера одного (Х10) из ISSR-праймеров (табл. 2).
У 26 исследуемых сортов T. aestivum выявлено 60 ISSR-маркеров. Установлено, что доля полиморфных локусов изученных сортов T. aestivum поддерживается на высоком уровне (Р95 = 0,83). Число амплифицированных фрагментов ДНК варьировалось в зависимости от праймера от 10 (праймеры М1, Х11) до 15 (праймер Х10), а их размеры – от 170 до 1770 п.н. В среднем при ISSR-анализе сортов T. aestivum один праймер инициировал синтез 12 фрагментов ДНК. Амплифицированные фрагменты ДНК были отнесены к мономорфным, если частота их встречаемости была > 0,95. Фрагменты с меньшей частотой встречаемости были отнесены к полиморфным.
Таблица 1
Эффективность ISSR-праймеров
|
№ п/п |
Праймер |
Нуклеотидная последовательность праймера (5’→3’) |
Температура отжига праймера (Tm,C) |
Эффективность праймера |
|
1 |
M1 |
аca-cac-aca-cac-aca-ccg |
56 |
5 |
|
2 |
M2 |
aca-cac-aca-cac-aca-ccc |
56 |
1 |
|
3 |
M3 |
aca-cac-aca-cac-aca-cct |
54 |
5 |
|
4 |
M9 |
gac-acg-aca-cga-cac-gac-ac |
62 |
2 |
|
5 |
M27 |
gag-aga-gag-aga-gag-ac |
52 |
5 |
|
6 |
Х1 |
cac-aca-cac-aca-g |
61 |
1 |
|
7 |
X9 |
acc-acc-acc-acc-acc-acc-g |
64 |
3 |
|
8 |
X10 |
agc-agc-agc-agc-agc-agc-c |
64 |
5 |
|
9 |
Х11 |
agc-agc-agc-agc-agc-agc-g |
64 |
5 |
|
10 |
ISSR-1 |
aca-cac-aca-cac-aca-ct |
50 |
4 |
|
11 |
ISSR-3 |
tgt-gtg-tgt-gtg-tgt-gaa |
52 |
3 |
|
12 |
ISSR-4 |
tgt-gtg-tgt-gtg-tgt-ggc |
56 |
2 |
|
13 |
ISSR-5 |
aga-gag-aga-gag-aga-gca |
54 |
4 |
|
14 |
ISSR-6 |
aga-gag-aga-gag-aga-gcg |
56 |
4 |
|
15 |
ISSR-7 |
ctc-ctc-ctc-ctc-ctc-ctc-c |
64 |
2 |
|
16 |
ISSR-8 |
gag-gag-gag-gag-gag-gag-c |
64 |
1 |
|
17 |
ISSR-9 |
acg-acg-acg-acg-acg-acg-acg-g |
64 |
2 |
|
18 |
ISSR-10 |
atg-atg-atg-atg-atg-atg-atg-c |
60 |
2 |
|
19 |
CR-212 |
ctc-tct-ctc-tct-ctc-ttg |
54 |
3 |
|
20 |
CR-215 |
cac-aca-cac-aca-gt |
42 |
4 |
|
21 |
CR-216 |
gag-aga-gag-aga-gg |
44 |
1 |
|
22 |
CR-217 |
gtg-tgt-gtg-tgt-gg |
44 |
2 |
|
23 |
CR-218 |
gag-aga-gag-aga-cc |
44 |
4 |
Примечания: М1 – CR-218 – обозначения праймеров; шкала эффективности праймеров: 5 – очень высокая; 4 – высокая; 3 – средняя; 2 – низкая; 1 – очень низкая [5].
Таблица 2
Наличие или отсутствие ампликонов, выявляемых с использованием праймера Х10 у 26 сортов T. aestivum
|
Сорт |
Ампликон, п.н. |
|||||||||||||||
|
1770 |
1180 |
950 |
840 |
670 |
620 |
550 |
480 |
450 |
400 |
370 |
340 |
300 |
250 |
200 |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
|
1 |
Московская 39 |
0 |
0 |
0 |
1 |
1 |
0 |
1 |
1 |
1 |
0 |
1 |
0 |
1 |
1 |
0 |
|
2 |
Волжская К |
1 |
1 |
1 |
1 |
0 |
1 |
1 |
1 |
1 |
0 |
1 |
1 |
1 |
0 |
0 |
|
3 |
Иргина |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
1 |
0 |
1 |
0 |
1 |
0 |
0 |
|
4 |
Ирень |
0 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
|
5 |
Стрела |
0 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
0 |
1 |
0 |
0 |
|
6 |
Красноуфимская 100 |
0 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
0 |
|
7 |
Свеча |
0 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
0 |
|
8 |
Горноуральская |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
1 |
0 |
1 |
0 |
1 |
0 |
0 |
|
9 |
Терция |
0 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
1 |
1 |
1 |
1 |
0 |
|
10 |
Экада 70 |
0 |
0 |
0 |
1 |
0 |
0 |
1 |
0 |
1 |
1 |
1 |
0 |
1 |
1 |
0 |
|
11 |
Экада 109 |
1 |
0 |
1 |
1 |
0 |
1 |
1 |
0 |
1 |
1 |
1 |
0 |
1 |
0 |
0 |
|
12 |
Штру 06 |
0 |
0 |
1 |
1 |
0 |
1 |
1 |
0 |
1 |
0 |
1 |
0 |
1 |
1 |
0 |
|
13 |
Штру 05 |
1 |
1 |
1 |
1 |
0 |
1 |
1 |
1 |
1 |
0 |
1 |
0 |
1 |
0 |
0 |
|
14 |
Икар |
1 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
1 |
0 |
1 |
0 |
0 |
|
15 |
Баженка |
0 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
1 |
0 |
1 |
0 |
0 |
|
16 |
Гамлет |
0 |
1 |
1 |
1 |
0 |
1 |
1 |
1 |
1 |
0 |
1 |
1 |
1 |
0 |
0 |
|
17 |
Диаблон |
1 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
1 |
0 |
1 |
1 |
0 |
|
18 |
Терси |
0 |
0 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
1 |
0 |
1 |
1 |
0 |
|
19 |
Уралосибирская |
1 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
1 |
0 |
1 |
1 |
0 |
|
20 |
Ярица |
1 |
1 |
1 |
1 |
0 |
1 |
1 |
1 |
1 |
0 |
1 |
0 |
1 |
1 |
0 |
|
21 |
Красноуфимская 110 |
1 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
0 |
1 |
1 |
1 |
1 |
0 |
|
22 |
Башкирская 4 |
1 |
1 |
1 |
1 |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
|
23 |
Башкирская 26 |
0 |
1 |
0 |
1 |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
|
24 |
Башкирская 28 |
0 |
1 |
1 |
1 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
|
25 |
Жница |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
0 |
|
26 |
Фотос |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
1 |
Примечания: Московская 39 – Фотос – название сортов; 1770–200 – длины ISSR-маркеров, выявленные с помощью праймера Х10; темно-серым цветом выделены сортоспецифичные фрагменты, серым – полиморфные фрагменты; светло-серым – видовые фрагменты.
Использованные в работе ISSR-праймеры (М1, М3, М27, Х10, Х11) позволили получить для каждого сорта оригинальный спектр ампликонов и показали высокую информативность и стабильность. Нами было выявлено девять ISSR-фрагментов, характерных для всех 26 исследованных сортов T. aestivum, и три фрагмента – характерных для представителей только одного конкретного сорта, то есть сортоспецифичные. В частности, у образцов сорта Московская 39 присутствовал один уникальный фрагмент размером 670 п.н. (праймер Х10), идентифицировались фрагменты, специфичные для сортов Волжская К (850Х11) и Фотос (200Х10). Для каждого сорта был получен индивидуальный спектр ISSR-фрагментов. Эти фрагменты использованы нами при составлении молекулярно-генетических формул каждого из 26 исследуемых сортов T. aestivum. Четко воспроизводимые ISSR-фрагменты, выявленные у всех 26 сортов, мы обозначили как «видовые» и обозначили их «v» от «vid». Фрагменты, которые были выявлены только у некоторых сортов, мы обозначили как полиморфные – «р» от «polymorph» [1]. Сортоспецифичные фрагменты мы обозначили как «us» от «unique + sort» (уникальный сортовой). Нами были установлены специфичные для каждого сорта сочетания ISSR-фрагментов. Для идентификации сортов было отобрано по 4 видовых, 4 полиморфных и 1 сортоспецифичному ISSR-фрагменту. Например, молекулярно-генетическая формула сорта Фотос выглядит следующим образом (табл. 3):
Таблица 3
Молекулярно-генетическая формула сорта Фотос T. aestivum
|
Обозначение сорта |
Тип фрагментов ДНК |
Молекулярно-генетическая формула |
|
Ta_фот |
vid |
Ta_фотv840X10, Ta_фотv680X11, Ta_фотv440M3, Ta_фотv370M1 |
|
polimorph |
Ta_фотp1180X10, Ta_фотp680M3, Ta_фотp460M27, Ta_фотp330X11 |
|
|
unique + sort |
Ta_фотus200X10 |
Генотипы 26 изученных сортов пшеницы мягкой на основании ISSR-анализа имеют ряд индивидуальных генетических отличий. Наибольшее сходство имеют ISSR-маркеры сортов Икар и Баженка (95,0 %). Наименьшее сходство выявленных ISSR-маркеров (48,3 %) имеют сорта Иргина и Красноуфимская 110, Горноуральская и Красноуфимская 110.
Рассчитанные на основе ISSR-спектров и данных о полиморфизме ДНК-фрагментов коэффициенты попарных генетических различий у разных сортов T. aestivum варьировались от 0,051 до 0,727. На основании полученной матрицы невзвешенным парно-групповым методом (UPGMA) была построена дендрограмма, отражающая степень родства исследуемых сортов по ISSR-спектрам. Дендрограмма, построенная по данным кластерного анализа, выявила четкую сортовую дифференциацию T. aestivum, разделив исследованные сорта на шесть основных групп (рисунок). Согласно нашим результатам 7 сортов сгруппировались в группу I, 5 сортов – в группу II, в группе III отмечен 1 сорт, в группе IV – 8 сортов, в группе V – 2 сорта и в последней группе (VI) – 3 сорта. Межсортовые группировки каждой клады поддерживались высокими значениями бутстрепа (от 50 до 93 %).
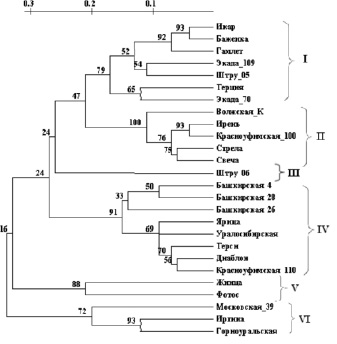
UPGMA-дендрограмма генетического сходства 26 сортов T. aestivum, построенная на основании полиморфизма 60 ISSR-маркеров. Шкала сверху – генетические дистанции [9]. На дендрограмме цифрами указаны значения бутстрепа (в %)
Первый кластер был представлен сортами, характеризующимися высокой адаптивностью к засухе [8] – Икар, Баженка, Гамлет, Экада 109, Штру 05, Терция и Экада 70. Второй кластер образовали ранне- и среднеспелые сорта – Ирень, Красноуфимская 100, Волжская К, Стрела и Свеча. Особенностью третьего кластера является то, что в него вошел только один сорт Штру 06, что по нашему предположению может быть связано с его происхождением (сорт немецкой селекции). Сорта IV группы – среднеспелые (Башкирская 4, Башкирская 26, Башкирская 28, Ярица, Уралосибирская, Терси, Диаблон, Красноуфимская 110). Группу V составили два сорта, что можно объяснить их хорошей устойчивостью к ранним весенним и осенним заморозкам. Сорта IV группы пластичны в изменяющихся условиях среды [8].
Проведенные исследования позволили провести молекулярно-генетическую идентификацию перспективных для возделывания на Урале сортов пшеницы мягкой и открыли возможность изучения взаимосвязи генетических и агрономических характеристик сортов T. aestivum, а также механизмов устойчивости в резко изменяющихся условиях Пермского края, относящегося к зоне рискованного земледелия [7], и республики Башкортостан, в которой в последние годы отмечены засушливые периоды [2].
Заключение
Таким образом, у изученных 26 сортов T. aestivum выявлено 60 ISSR-маркеров. Установлено, что доля полиморфных локусов у этих сортов высока (Р95 = 0,83). Определены мономорфные, полиморфные и сортоспецифические ISSR-маркеры. Для каждого из 26 изученных сортов пшеницы мягкой получены уникальные ISSR-спектры, составлены молекулярно-генетические формулы и генетические паспорта. На основе вариабельности межмикросателлитных последовательностей у исследованных сортов определена степень генетических различий и построена дендрограмма. Полученные результаты могут быть использованы в селекционных программах при генетической идентификации сортов, для защиты авторских прав и для контроля за распространением перспективного селекционного материала.
Работа выполнена в соответствии с государственным заданием на оказание услуг, частично финансируемых Министерством образования и науки РФ из средств федерального бюджета, на оборудовании, закупленном в ходе реализации проекта развития Пермского национального исследовательского университета.
Рецензенты:
Переведенцева Л.Г., д.б.н., профессор, профессор кафедры ботаники и генетики растений ФГБОУ ВПО «Пермский государственный национальный исследовательский университет», г. Пермь;
Янбаев Ю.А., д.б.н., профессор, профессор кафедры лесоводства и ландшафтного дизайна факультета землеустройства и лесного хозяйства ФГБОУ ВПО «Башкирский государственный аграрный университет», г. Уфа.
Работа поступила в редакцию 04.04.2012



