Использование отходов ГОКов при производстве обжиговых вяжущих [8, 1], изделий автоклавного твердения [3] невозможно без исследования влияния входящих в состав минералов на процессы твердения известково-кварцевой смеси. Поэтому необходимо изучить поведение некоторых железосодержащих сульфидов в гидротермальных условиях, оценить энергетическую возможность протекания реакций окисления, гидратации, взаимодействия, определить, какие в результате этих процессов возникают новообразования и как все это в совокупности скажется на качестве получаемых изделий.
Отсев дробления метаморфических сланцев ГОКов, кроме кварца, слоистых алюмосиликатов содержит сульфиды железа в количестве до 10 % (пирит, марказит, халькопирит) [3]. Хвосты мокрой магнитной сепарации железной руды, которые складируются в отвалы, также содержат кварц, некоторое количество биотита (до 10–15 %), гематита a-Fe2O3. Поведение железосодержащих минералов, особенно сульфидов в силикатных смесях, носит спорный характер.
По данным [2], пирит и марказит относится к минералам, химически неустойчивым к воздействию атмосферы и поровой жидкости цементного камня, способным к окислению и гидратации. На основании диаграмм Eh-pH системы FeS2–H2O определена термодинамическая устойчивость пирита в жидкой фазе твердеющего цемента [7].
При температуре 20 °С после семисуточного пребывания пирита в воде не наблюдается изменения рН-жидкой фазы, по результатам химического анализа в растворе отсутствуют ионы SО42– и железа. Микроскопические исследования и рентгенофазовый анализ свидетельствуют об отсутствии процессов окисления пирита.
При повышении температуры раствора до 100 °С при атмосферном давлении наблюдается слабое окисление пирита на поверхности зерен, а при исследовании жидкой фазы тонкоизмельченного пирита рН среды уменьшается до 4,498, количество SО42– в растворе составляет 12,3 % в пересчете на SО3 от общего содержания серы в исходном FeS2.
В условиях гидротермальной обработки при температуре 200 °С и давлении насыщенного пара 1,6 МПа процесс окисления пирита ускоряется, зерна минерала покрываются оксидной пленкой Fe2О3. С увеличением количества продуктов окисления, покрывающих зерна исходных минералов, процесс значительно замедляется. В случае мелкодисперсного пирита рН-среды составляет 4,49, количество SО42– в жидкой фазе составляет 16,3 % в пересчете на SО3, а Fe3+ – 5,07 % от содержания железа в исходном пирите.
При использовании концентрированного раствора перекиси водорода наблюдается интенсивное взаимодействие его с FeS2, которое сопровождается интенсивным выделением тепла. Процесс окисления протекает по механизму:
2FeS2 + 18H2O + 17О2 → 2Fe(ОН)4– + 4SО42– + 28ОН–.
С увеличением степени несовершенства структуры и дисперсности пирита интенсивность и степень окисления возрастает.
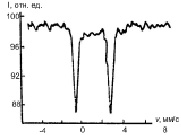
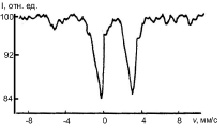
Основу структуры пирита составляет кубическая решетка. Каждый ион двухвалентного железа окружен шестью спаренными ионами [S2]2– [5]. Спектр пирита представляет собой одинарный симметричный квадрупольный дублет. Мессбауэровские спектры пирита, прошедшего гидротермальную обработку при температуре 100 и 200 °С (рис. 1), обнаруживают асимметрию, обусловленную тем, что наблюдается заметное уширение левой компоненты в верхней части, кроме того, существует и интегральная асимметрия: отношение интенсивностей левой и правой компонент равно 0,11 ± 0,05.
 б
б 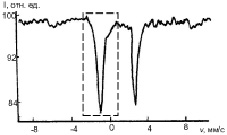
 г
г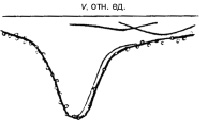
Рис. 1. Мессбауэровские спектры поглощения природного (а), пропаренного (б) и после гидротермальной обработки (в) пирита и разложение участка спектра, заключенного в прямоугольник, на компоненты (г)
Математическая обработка спектров, проведенная на ПК, показала, что эти спектры можно представить в виде суперпозиции двух дублетов, параметры одного из которых соответствуют ионам Fe2+, параметры другого – ионам Fe3+ (табл. 1).
Таблица 1
Параметры спектров ЯГР (мм/с)
|
Номер образеца |
Температура обработки, °С |
Г1 |
Г2 |
e1 |
e2 |
d*1 |
d2 |
|
1 |
20 |
0,41 |
0,41 |
2,70 |
– |
1,45 |
– |
|
2 |
100 |
0,33 |
0,41 |
2,95 |
0,25 |
1,50 |
0,60 |
|
3 |
200 |
0,33 |
0,41 |
2,95 |
0,33 |
1,45 |
0,56 |
Примечание. * – значения химического сдвига приведены относительно нитропрусида натрия
Содержание Fe3+, определенное по данным ЯГР-спектроскопии и расчета (табл. 2), хорошо согласуются между собой – в среднем различие составляет 0,3 %. В то время как химический анализ дает величину Fe3+, завышенную примерно на 1,5 %. Неточность химического анализа связана с трудностями определения трехвалентного железа в присутствии Fe2+.
Таблица 2
Содержание трехвалентного железа по данным ЯГР-спектроскопии (Fe3+ЯГР), химического анализа (Fe3+х.а) и расчета по математической модели (Fe3+расч)
|
Номер образеца |
Fe3+ЯГР |
Fe3+х.а |
Fe3+расч |
|
2 |
0,67 |
0,70 |
2,3 |
|
3 |
4,20 |
3,90 |
5,1 |
Анализ ЯГР-спектров проб пирита показал, что спектр пирита представляет собой симметричный квадрупольный дублет. После гидротермальной обработки пирита обнаружено отклонение от симметрии дублета, он становится асимметричным, что вызвано наличием ионов Fe3+.
При исследовании поведения пирита в смеси с известью в гидротермальных условиях определено для молекулярного соотношения СаО:FeS2 ≤ 2 после 12 часов выдержки образуются ангидрит, гематит, гидроксид железа. Однако степень окисления мелкодисперсного пирита мала и составляет ~ 27 %.
С целью ускорения процессов окисления и взаимодействия и выявления возможных продуктов реакции в смесь вводили в качестве интенсификатора перекись водорода [6]. После 24 часов гидротермального твердения по результатам рентгенофазового, проведенного при использовании Fe-антикатода (рис. 2) и дифференциально-термического анализа (рис. 3) обнаружены кристаллы гидроферрита C3FH6.
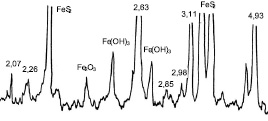
Рис. 2. Рентгенограмма пирита, автоклавированного в смеси Са(ОН)2-FeS2
Дифракционные максимумы 2,98; 2,26 Å и эндотермические эффекты (–) 120, (–) 185, (–) 330 °С свидетельствуют о наличии высокосульфатной формы гидросульфоферрита кальция 3СаО∙Fe2O3∙3CaSO4∙32H2O, который по своим морфологическим и структурным свойствам аналогичен эттрингиту – сульфоалюминату кальция и при температурах 150–200 °С является неустойчивым соединением [9].
По результатам химического анализа (табл. 3), исходя из расчета по количеству прореагировавших исходных компонентов, новообразования имеют состав хСаО∙уFe2O3∙zCaSO4∙nH2O близкого к высокосульфатной форме гидросульфоферрита кальция.
Смеси 1-1 и 2-1 автоклавировали по режиму – 2-12-2; смеси 1-2 и 1*-2 – 2-24-2.
Таблица 3
Результаты химического анализа смеси СаО–FeS2–H2O2 после гидротермальной обработки при температуре 175 °С
|
Номер смеси |
Содержание Са(ОН)2, % |
Содержание FeS2, % |
п.п.п., % |
Расчетная формула новообразований хСаО∙уFe2O3∙zCaSO4∙nH2O |
||
|
исх. |
после автоклав. |
исх. |
после автоклав. |
|||
|
1-1 |
55,16 |
35,74 |
44,84 |
32,70 |
33,29 |
3,37СаО∙8,1Fe2O3∙27,1CaSO4∙nH2O |
|
2-1 |
68,25 |
40,53 |
31,75 |
11,95 |
47,52 |
2,5СаО∙13,2Fe2O3∙44,9CaSO4∙nH2O |
|
1-2 |
55,16 |
34,85 |
44,84 |
32,68 |
34,02 |
4,1СаО∙8,15Fe2O3∙27,4CaSO4∙nH2O |
|
1*-2 |
55,16 |
7,26 |
44,84 |
38,45 |
38,45 |
24,51СаО∙8,34Fe2O3∙28,52CaSO4∙nH2O |
Примечание. * – использование окислителя.
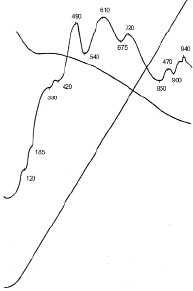
Рис. 3. Термограмма автоклавированной смеси Са(ОН)2–FeS2 (2-24-2)
Следовательно, при окислении пирита образуются ионы SO42– и Fe3+, в присутствии которых (в гидротермальных условиях) ускоряется процесс растворения Са(ОН)2 и образование гидроферритов и гидросульфоферитов кальция.
Исследование поведения пирита в известково-кварцевой смеси проводили в образцах силикатного вяжущего состава СаО:SiO2 = 1, изготовленных с введением различного количества порошкообразного (частицы менее 0,08 мм) либо зернистого пирита (частицы размером 1–3 мм), а также их смеси при определенном соотношении. Введение пирита ограничивали количеством не более 10 %.
Анализ полученных данных (табл. 4) показывает, что с увеличением размера зерен пирита прочность силикатного вяжущего снижается, а увеличение содержания порошка до 5 % приводит к ее повышению. Однако при введении пирита в количестве 7–10 % от массы вяжущего прочность образцов понижается, но абсолютное ее значение близко по значению к прочности вяжущего без добавки.
Добавка пирита способствует появлению сульфат ионов SO42– в жидкой фазе, что ускоряет процесс растворения гидроксида кальция Са(ОН)2, а тем самым его взаимодействие с кремнекислотой и образование гидросиликатов кальция. После 4-х часов изотермической выдержки появляется CSH (I), переходящий при длительном автоклавировании в тоберморит. Количество CSH (I) и тоберморита в образцах заметно повышается уже при 1 %-ной добавке пирита. При содержании пирита 7–10 % в образцах после 12 часов автоклавирования обнаруживается безводный ангидрит CaSO4, возможно способствует увеличению доли непрореагировавшего кварца в смеси. В данном случае возможно изоморфное замещение кремнекислородных тетраэдров на сульфат ионы в решетке гидросиликата кальция [4].
Микроскопический анализ автоклавированной смеси СаО-SiO2-FeS2-H2O [6] свидетельствует о том, что основная часть пирита (n = 6,22) сохраняет свою структуру. Окисление возможно только на поверхности зерна. На отдельных участках (увеличение (×288)) видны волокнистые скопления (n = 1,53-1,54), что можно отнести к низкоосновному гидросиликату CSH (I). На границе частиц пирита с известкого-кварцевым вяжущим встречаются кристаллы Fe2O3, Fe(OН)3 и очень редко C3FH6. Новообразований состава C3FСS3H32 не обнаружено.
Таблица 4
Свойства известково-кварцевого вяжущего автоклавного твердения с добавкой пирита
|
Добавка пирита, % |
Содержание Са(ОН)2своб., % |
Нерастворим. остаток, % |
п.п.п., % |
Прочность при сжатии, МПа |
|
|
менее 0,08 мм |
частицы 1–3 мм |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
– |
– |
1,90 |
8,65 |
10,86 |
48,5 |
|
1 |
– |
1,48 |
8,50 |
11,45 |
50,8 |
|
3 |
– |
1,23 |
8,21 |
9,48 |
53,6 |
|
5 |
– |
1,10 |
7,67 |
8,95 |
54,7 |
|
7 |
– |
1,03 |
7,60 |
8,80 |
52,0 |
|
10 |
– |
1,00 |
7,45 |
9,51 |
44,3 |
|
– |
1 |
1,95 |
9,60 |
11,30 |
43,0 |
|
– |
3 |
1,98 |
10,1 |
12,72 |
40,3 |
|
– |
5 |
2,50 |
10,5 |
12,50 |
39,6 |
|
– |
7 |
3,30 |
11,0 |
11,93 |
37,9 |
|
– |
10 |
4,50 |
15,4 |
11,57 |
37,5 |
|
1 |
3 |
2,33 |
9,15 |
12,45 |
44,6 |
|
4 |
1 |
0,80 |
8,12 |
10,40 |
54,5 |
Следовательно, возможность процесса взаимодействия пирита в силикатных смесях определяется окислительным потенциалом системы. Окисление пирита может привести к улучшению свойств силикатных изделий. Взаимодействие идет по поверхности зерна, фазовый состав новообразований зоны контакта – кальциевые гидраты C3FH6, возможно образование гидроксида и оксида железа.
Рецензенты:
Везенцев А.И., д.т.н., профессор, заведующий кафедрой общей химии Национального исследовательского университета «БелГУ», г. Белгород;
Немец И.И., д.т.н., профессор кафедры строительного материаловедения, изделий и конструкций Белгородского государственного технологического университета им. В.Г. Шухова, г. Белгород.
Работа поступила в редакцию 03.06.2013.



