Хорошо известно, что одинаковые по силе, но разные по длительности воздействия вызывают качественно разные ответные реакции живой ткани. При этом необходимо учитывать также и условия, в которых находился организм или орган к моменту того или иного воздействия. Примером этого может служить явление кросс-адаптации, когда приспособление к какому-либо уже имеющемуся воздействию изменяет чувствительность к другим, качественно близким раздражителям [3].
Хорошо известно, что нарушения метаболизма миокарда при ишемической и диабетической кардиомиопатии имеют много общего [1]. Но при одинаковой выраженности коронарной недостаточности у больных с сахарным диабетом (СД) в несколько раз выше риск летального исхода после острого инфаркта миокарда [6]. С другой стороны, показано, что индукция СД при развитии постинфарктного ремоделирования сердца лабораторных животных способствует сохранению энергетического метаболизма миокарда и сократительной функции сердца [4, 10]. Несмотря на некоторые предположения, выдвинутые в этих работах, в целом механизмы данного феномена во многом остаются неизвестны.
Цель работы – исследовать структурные изменения миокарда при постинфарктном и диабетическом поражении сердца, в условиях их раздельного и сочетанного развития в эксперименте.
Материал и методы исследования
Исследования проведены на половозрелых крысах-самцах линии Вистар массой 250–300 г. Были сформированы следующие группы: I группа (контрольная) – интактные животные; II группа – животные после моделирования инфаркта; III группа – животные с индуцированным диабетом – СД; IV группа – животные с сочетанием патологий «инфаркт + СД» (таблица).
Для моделирования инфаркта миокарда животным под эфирным наркозом накладывали лигатуру в верхней трети левой передней нисходящей коронарной артерии [2]. Развитие постинфарктных изменений верифицировали морфологически, как описано ранее [2, 4]. Сахарный диабет индуцировали однократным введением стрептозотоцина («Sigma», США) в дозе 60 мг/кг внутрибрюшинно, разведенного 0,01 моль/л цитратным буфером (рН 4,5) [2]. Верификацию осуществляли по увеличению концентрации глюкозы в крови крыс в 3–4,5 раза, снижению массы тела, развитию полиурии и полидипсии [2, 4].
Экспериментальные группы животных
|
Группы животных |
Время между моделированием первой и второй патологии (недели) |
Время между моделированием второй патологии и забоем животных (недели) |
Общая длительность патологического воздействия (недели) |
Число крыс в группе (n) |
|
I |
– |
– |
– |
5 |
|
II |
6 |
– |
6 |
5 |
|
III |
6 |
– |
6 |
5 |
|
IV |
4 |
2 |
6 |
5 |
Для моделирования сочетанной патологии через 4 недели после коронароокклюзии животным однократно вводили стрептозотоцин в дозе 60 мг/кг внутрибрюшинно [2].
Всех животных содержали в стандартных условиях вивария. Животных выводили из эксперимента, используя рауш-наркоз.
Для морфологического исследования у животных II и IV групп использовали фрагменты сохранного миокарда левого желудочка, примыкающего к рубцовой зоне. У животных I и III групп образцы брали из анатомически сопоставимых участков. Образцы фиксировали в 10 % нейтральном формалине. Осуществляли стандартную гистологическую проводку в спиртах и заливку материала в парафин. Готовили серийные срезы толщиной 4–5 мкм, которые окрашивали гематоксилин-эозином и пикрофуксином по методу Ван Гизона.
Параллельно из тех же участков миокарда проводили забор материала для электронной микроскопии. Образцы фиксировали сначала 2,5 % глютаровым альдегидом, а затем в 1 % растворе четырехокиси осмия. Полученный материал дегидратировали в этиловых спиртах восходящей концентрации и заливали в арадилат. Ультратонкие срезы толщиной 30–60 нм готовили на ультратоме «Ultrotom 111». Полученные срезы наносили на сетки с формваровым покрытием и контрастировали 2 % уранилацетатом и цитратом свинца.
Микроскопическое исследование срезов на светооптическом уровне выполняли, используя бинокулярный микроскоп Karl Zeis «Axiolab A1». Оценивали следующие гистологические параметры: наличие и выраженность периваскулярного фиброза, диффузного и мелкоочагового фиброза и мононуклеарной инфильтрации стромы миокарда. При исследовании кардиомиоцитов оценивали наличие и выраженность миоцитолиза, миоцитолизиса и глыбчатого распада. Методом трансмиссионной электронной микроскопии исследовали кардиомиоциты для выявления изменений в ультраструктуре митохондрий и миофибрилл. Полученные препараты просматривали в электронном микроскопе «JEM-100CX11» («JEOL», Япония) с апертурной диафрагмой 25–30 мкм при ускоряющем напряжении 80 кВ.
Результаты исследования и их обсуждение
Типичный вид миокарда крыс контрольной группы и животных с монопатологиями представлен на рис. 1. Показано, что по сравнению с контрольными животными для миокарда крыс с постинфарктным кардиосклерозом характерны разобщенность, частичная фрагментация и неупорядоченность расположения мышечных волокон. В клетках определяются дегенеративные изменения: глыбчатый распад цитоплазмы миоцитов, миоцитолиз, миоцитолизис. В миокарде животных с СД наблюдались однотипные структурные изменения, однако степень выраженности миоцитолиза и миоцитолизиса была менее значима. Наряду с этим в обеих патологических группах отмечались признаки полиморфизма ядер, утрата кардиомиоцитами поперечной исчерченности и матовость цитоплазмы. В строме миокарда выявлялись умеренно выраженные мононуклеарная инфильтрация, диффузный и мелкоочаговый кардиосклероз, периваскулярный фиброз (рис. 1, Б-Е). Полученные данные демонстрируют, что в условиях эксперимента при ишемической и диабетической кардиомиопатии миокард имеет схожие структурные изменения, что сопровождается одинаково выраженными метаболическими и функциональными расстройствами, как показано нами ранее [4, 10].
Исследование структуры миокарда при сочетанной патологии (рис. 2) показало наличие менее выраженных в сравнении с монопатологиями деструктивных изменений миокарда. При сочетанной патологии в миокарде отмечалось более упорядоченное и компактное расположение пучков мышечных волокон. При этом межклеточные пространства были слегка расширены за счет тонких прослоек интерстициальной ткани, представленных тонкими, извилистыми коллагеновыми волокнами и фибробластами (рис. 2, А). Диффузный и мелкоочаговый фиброз стромы миокарда, а также периваскулярный фиброз в миокарде крыс с сочетанной патологией были выражены слабо (рис. 2, Б–В) и регистрировались лишь в половине случаев. Мононуклеарная инфильтрация стромы миокарда также была обнаружена лишь в половине случаев наблюдения и характеризовалась более слабой выраженностью, чем в группах с монопатологиями.
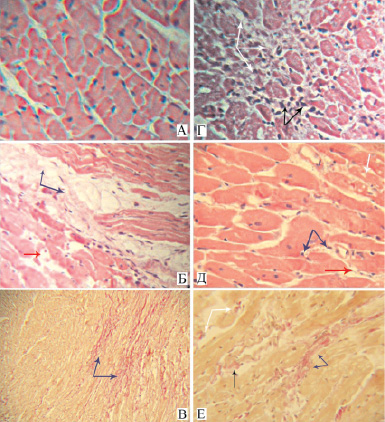
Рис. 1. Морфологическая картина миокарда левого желудочка в контрольной группе (А), группах с инфарктом (Б, В, Г) и диабетом (Д, Е):А – I группа, интактный миокард, окраска гематоксилин-эозин, х400; Б – II группа, диффузный фиброз стромы миокарда (синие стрелки), миоцитолиз мышечных волокон (красная стрелка), окраска гематоксилин-эозин, х200; В – II группа, диффузный фиброз стромы миокарда (синие стрелки), окраска пикрофуксин, х100; Г – II группа, мелкоочаговый фиброз стромы миокарда (белые стрелки), мононуклеарная инфильтрация (черные стрелки), окраска гематоксилин-эозин, х200; Д – III группа, слабо выраженная мононуклеарная инфильтрация стромы миокарда (синие стрелки), вакуолизация цитоплазмы кардиомиоцитов (белая стрелка), миоцитолиз мышечных волокон (красная стрелка), окраска гематоксилин-эозин, х 400; Е – III группа, диффузный (белые стрелки) и мелкоочаговый фиброз (синие стрелки) стромы миокарда, периваскулярный фиброз (черная стрелка), окраска пикрофуксин, х400
Полученный результат может быть обусловлен тем, что компенсаторно-приспособительные процессы в миокарде при развитии патологий сочетают деструктивные изменения с регенераторными реакциями [5, 7]. Нарушение кровоснабжения и инфаркт миокарда являются прямым вмешательством в работу сердца, что может предполагать активацию специфических для данного органа защитных реакций. Диабетическое поражение миокарда является следствием изменений метаболизма на уровне всего организма. Определенные морфологические различия в реакции миокарда на отдельные и сочетанные патологии могут быть обусловлены тем, что в разных исходных условиях одни и те же стресс-факторы могут восприниматься как различные по силе или степени биологической активности, что, в свою очередь, будет определять разные по качеству стандартные адаптационные реакции организма [3]. Действительно, в проведенных нами ранее исследованиях показано, что повышенная сопротивляемость к патологическому воздействию возникала только в том случае, если СД вызывали у животных на стадии сформированного постинфарктного кардиосклероза [4, 10]. На более ранних или отдаленных сроках этот эффект был менее выражен или отсутствовал, как и в случае обратного сочетания (инфаркт на фоне СД) [4]. Возможно, острая ишемия миокарда вследствие коронароокклюзии запускает в сердце мощную и генерализованную реакцию адаптации. Напротив, постепенное нарастание метаболических изменений в кардиомиоцитах при развитии СД приводит к хорошо известной в физиологии реакции привыкания (аккомодации), то есть отсутствию реакции на медленно нарастающий по силе раздражитель.
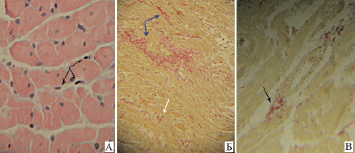
Рис. 2. Морфологическая картина миокарда левого желудочка при сочетанной патологии (IV группа):А – Слабо выраженная мононуклеарная инфильтрация стромы миокарда (черные стрелки), отсутствие выраженности дегенеративных изменений кардиомиоцитов, окраска гематоксилин-эозин, х400; Б – Слабо выраженный диффузный и мелкоочаговый фиброз стромы миокарда (белая и синие стрелки, соответственно), окраска пикрофуксин, х100; В – Слабо выраженный периваскулярный фиброз (черная стрелка), окраска пикрофуксин, х200
Функциональную состоятельность мышечных клеток, в особенности кардиомиоцитов, определяет, в первую очередь, их энергетическое обеспечение. Общепризнанно, что основным поставщиком энергии в клетке являются митохондрии. Соответственно, изменения в структуре митохондрий, межмитохондриальных связей, плотности контакта с миофибриллами могут быть определяющим фактором в формировании адаптивного ответа при отдельных и сочетанных патологиях.
Для ответа на вопрос, насколько различными и выраженными являются деструктивные изменения в митохондриальном и сократительном аппарате кардиомиоцитов при рассматриваемых патологиях на ультраструктурном уровне, было проведено электронно-микроскопическое исследование (рис. 3). При обеих патологиях наблюдались типичные дегенеративные изменения митохондрий [5, 7, 8]: набухание органелл, просветление, вымывание и гомогенизация митохондриального матрикса, деструкция крист (рис. 3, В, Д). Обращает на себя внимание выраженная разобщенность в расположении митохондрий как между собой, так и контакта с миофибриллами, во II группе (рис. 3, В); в III группе, напротив, наблюдалась «гомогенизация» массы митохондрий: визуально трудно четко выделить границы органелл (рис. 3, Д). Помимо нарушений в структуре митохондрий присутствуют нарушения в сократительном аппарате кардиомиоцитов: смещение, «расплетание», неправильная ориентация, разрывы и фрагментация миофибрилл (рис. 3, В-Е). Более выраженная деградация миофибрилл наблюдается во II группе: часто встречаются хаотично расположенные тонкие волокна с выраженными просветами, разделенные на отдельные «пучки» (рис. 3, Б, В). В III группе миофибриллы расположены сравнительно более упорядоченно (рис. 3, В), однако и в этом случае наблюдается их выраженное «расплетание» (рис. 3, Г). Согласно существующим представлениям, подобные изменения характерны для миокарда при повышенной функциональной нагрузке и могут свидетельствовать не только о деградации, но и о гиперфункции клеточных органелл, в том числе и митохондриального аппарата [5, 7]. Однако выявленные различия в деструктивных изменениях митохондрий и миофибрилл при отдельных патологиях свидетельствуют о качественно разных реакциях миокарда на прямое (II группа) и опосредованное (III группа) повреждение миокарда.

Рис. 3. Структура кардиомиоцитов интактного (А, Б), постинфарктного (В, Г) диабетического (Д, Е) и при сочетанной патологии (Ж, З) миокарда крыс.Увеличение: А, В, Д, З – х1000; Ж – х1500; Б – х5000; Г – х4000; Е-х3000. Сокращения: Я – ядро, МХ – митохондрии, МФ – миофибриллы
Изучение ультраструктуры кардиомиоцитов IV группы выявило некоторое отличие в выраженности деструктивных изменений митохондрий и миофибрилл в сравнении с монопатологиями (рис. 3, Ж, З). При сочетании патологий наблюдалось сравнительно упорядоченное расположение миофибрилл с правильной поперечной исчерченностью и относительно плотной упаковкой миофиламентов (рис. 3, Ж, З). Большинство митохондрий имело просветленный матрикс, нарушенную пространственную ориентацию крист; часто встречаются крупные митохондрии с разрушенными кристами. Важно отметить, что в большинстве случаев митохондрии располагались цепочкой между миофибриллами, образуя с ними тесный контакт, как это характерно для интактных кардиомиоцитов (рис. 3, З). Считается, что подобные изменения митохондриального аппарата в кардиомиоцитах (гетерогенность ультраструктуры и популяции митохондрий, сохранение системы «митохондриального ретикулума»), могут являться проявлением эндогенных механизмов выживания клетки при длительной гипоксии миокарда [8, 9]. Предполагается, что в условиях хронической гипоксии одновременно происходит запуск двух разнонаправленных процессов:
1) митоптоза, направленного на выбраковку митохондрий с нарушенной функциональной активностью, а также митохондрий, ставших лишними для клеток в условиях недостатка кислорода;
2) образования новых митохондрий, направленного на сохранение хотя бы части органеллы в условиях тяжелого стрессорного воздействия [8, 9].
Можно предположить, что выявленные нами при сочетанной патологии изменения в структуре митохондрий свидетельствуют о запуске подобных процессов. Однако для уверенного ответа на этот вопрос требуются специальные обширные и детальные исследования ультраструктуры митохондриального аппарата.
Таким образом, проведенное нами исследование показало, что при экспериментальной ишемической и диабетической кардиомиопатии в миокарде наблюдаются сходные структурные изменения. Однако при сочетании патологий, когда на фоне сформированного постинфарктного кардиосклероза развивается СД, структурные нарушения миокарда на аналогичных сроках патологии оказываются менее выраженными, что, видимо, и определяет повышенную сопротивляемость миокарда животных к патологическому воздействию [4, 10].
Рецензенты:
Сахаров А.В., д.б.н., профессор, руководитель научно-образовательного центра «Экспериментальная и прикладная биология», ФГБОУ ВПО «Новосибирский государственный педагогический университет» Минобрнауки РФ, г. Новосибирск;
Логвинов С.В., д.м.н., профессор, заведующий кафедрой гистологии, эмбриологии и цитологии, ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, г. Томск.
Работа поступила в редакцию 08.05.2013.



