Течение физиологических процессов и выраженность патологических реакций в организме контролируются нейро-эндокринно-иммунными воздействиями, среди которых важную роль играют цитокины. Цитокиновой регуляцией обеспечиваются пролиферация, дифференцировка, функционирование клеток, межклеточные и межсистемные взаимодействия, направление и характер иммунного ответа на внедрение патогенов инфекционного и неинфекционного генеза. Установлено, что цитокины не однородны по строению, функциональной активности, клеткам-продуцентам [3, 4, 9]. Наибольшее число медиаторов иммунитета, открытых как продукт и факторы взаимодействия лейкоцитов, отнесено к интерлейкинам (ИЛ). Изучение сывороточных и тканевых концентраций цитокинов с определением их патогенетического значения при соматических заболеваниях различной локализации представляет значительный научно-практический интерес, способствуя уточнению и модификации диагностических алгоритмов, индивидуальной иммунокоррекции лечения.
Согласно данным ФГУ «ЦНИИОИЗ Минздравсоцразвития РФ» [12], в Республике Мордовия (РМ) в последние годы отмечается неустойчивая тенденция к росту первичной заболеваемости населения болезнями органов пищеварения, что особенно настораживает при снижении аналогичного общероссийского показателя. Так, в 2005 г. в РМ количество лиц с впервые в жизни установленным диагнозом заболевания органов пищеварения на 100000 населения составляло 3480, в 2009 г. – 3666,5, а в 2010 г. – 3838,4 и превысило аналогичный показатель в Приволжском федеральном округе на 7,4 %, в Российской Федерации в целом – на 14 %. Количество лиц с впервые установленным диагнозом гастрита и дуоденита на 100000 населения в 2005 г. в РМ составляло 438, в 2009 г. – 444,9, в 2010 г. – 474,9, с диагнозом язвенной болезни желудка и двенадцатиперстной кишки в 2005 г. – 131,2, в 2009 г. – 147,8, в 2010 г. – 146,9. Наблюдающаяся динамика свидетельствует о необходимости уточнения патогенетических механизмов развития заболеваний гастродуоденальной зоны и модификации применяемых лечебно-диагностических стандартов.
По данным Г.Н. Соколовой и В.Б. Потаповой [7], уровни тканевых и сывороточных цитокинов при язвенной болезни изменяются однонаправлено, при этом в сыворотке увеличение концентрации более выражено, чем в слизистой оболочке, и отражает динамику патологического процесса. Приведенные данные определили направление и цель исследования.
Цель исследования – изучить сывороточные концентрации интерлейкинов и патогенетическое значение их изменений у больных хроническим гастритом, язвенной болезнью желудка в стадии обострения.
Материал и методы исследования
Проведено комплексное клинико-лабораторное и инструментальное (эзофагогастродуоденоскопия (ЭГДС) с биопсией, 2-часовая рН-метрия) обследование 160 пациентов лечебно-профилактических учреждений г. Саранска с заболеваниями гастродуоденальной зоны и 30 клинически здоровых лиц.
Больные с обострением хронического гастрита (66 мужчин (55,9 %), 52 женщины (44,1 %), средний возраст по группе – 43,9 ± 7,5 года, длительность заболевания в среднем – 13,2 ± 5,1 года) были разделены на группы в зависимости от степени воспаления и стадии атрофии слизистой оболочки желудка (СОЖ), определенных морфологически [1], нарушения желудочной секреции. В 1-ю группу вошли 42 пациента с хроническим неатрофическим гастритом с сохраненной секреторной функцией (рН 1,6–2,0), во 2-ю – 40 больных очагово-атрофическим (І–ІІ ст.) гастритом с умеренной секреторной недостаточностью (рН 2,1–3,4), в 3-ю – 36 пациентов с распространенным атрофическим (ІІІ–ІV ст.) гастритом с выраженной гипосекрецией (рН 3,8–5,0). 42 пациента с обострением язвенной болезни желудка (рН 1,0–2,1) (мужчины – 57,5 %, женщины – 42,5 %) были объединены в 4-ю группу. Средний возраст больных составил 52,5 ± 10,1 года, длительность заболевания – 16,4 ± 8,6 года.
В контрольную группу вошли 30 практически здоровых добровольцев (мужчины – 53,3 %, женщины – 46,7 %, средний возраст – 36,2 ± 10,3 года), подобранных по принципу случайной выборки, не курящих и не имеющих на момент обследования клинических, лабораторных и инструментальных (ЭГДС) признаков обострения гастропатологии. Статистически значимых отличий по полу и возрасту между группами не выявлено.
Кровь в объеме 5 мл забиралась при получении информированного согласия обследуемых до начала активного лечения в утренние часы натощак из локтевой вены в пробирку без консервантов. Время коагуляции в пробирке не превышало 30 минут при комнатной температуре (20–25 °С). Сыворотка выделялась центрифугированием в течение 10 минут и помещалась в отдельные стерильные пробирки. Образцы хранились при температуре не выше –20 °С до комплектации, необходимой для заполнения микропланшета тест-системы для иммуноферментного анализа (не более 6 недель).
Методом твердофазного иммуноферментного анализа в сыворотке крови обследуемых определяли уровни ИЛ-1β, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-17, ИЛ-18 с применением наборов реагентов ЗАО «Вектор-Бест» (г. Новосибирск, Россия), следуя приложенным инструкциям. Фирмой-производителем диагностических тест-систем рекомендовано считать нормальным уровень ИЛ-1β, находящийся в диапазоне 0–11 пг/мл, ИЛ-2 – 0–10 пг/мл, ИЛ-4 – 0–4 пг/мл, ИЛ-6 – 0–10 пг/мл, ИЛ-8 – 0–10 пг/мл, ИЛ-10 – 0–31 пг/мл, ИЛ-17 – 0–5 пг/мл, ИЛ-18 – 104–640 пг/мл.
Статистическую обработку полученных данных проводили на компьютере с использованием пакета специальных прикладных программ Microsoft Excel 7.0 с вычислением значений средней арифметической (М), средней ошибки средней арифметической (m). О значимости различий в группах судили по вычислению критерия Стьюдента – t и степени вероятности – p. Достоверными считали различия при p ≤ 0,05.
Результаты исследования их обсуждение
У обследованных пациентов сывороточный уровень ИЛ-1β достоверно повышался относительно средних значений контрольной группы: в 1-й группе – на 169,3 %, во 2-й – на 136,5 %, в 4-й – на 192,7 %, в 3-й группе статистически значимых отличий не выявлено. Сывороточный уровень ИЛ-2 (таблица) превышал контрольные значения во всех группах больных (рк < 0,01–рк < 0,001). Количество данного цитокина у пациентов с распространенным атрофическим (ІІІ–ІV ст.) гастритом было больше средних цифр больных неатрофическим гастритом на 169,9 % (р1 < 0,01) и значений больных очагово-атрофическим (І–ІІ ст.) гастритом на 117,2 % (р2 < 0,05). При обострении язвенной болезни желудка отмечалось увеличение концентрации ИЛ-2 на 114,1 % относительно среднего уровня показателя у больных неатрофическим гастритом (р1 < 0,05).
Количество ИЛ-4 превышало средние значения контрольной группы в 1-й группе обследованных пациентов на 76,4 %, во 2-й – на 119,2 % (рк < 0,05), в 3-й – на 128,4 % (рк < 0,05), в 4-й – на 66,3 %. Сывороточный уровень ИЛ-6 у обследованных пациентов был выше средних значений контрольной группы: в 1-й группе – на 64,5 %, во 2-й – на 78,1 % (рк ≤ 0,05), в 3-й – на 35,7 %, в 4-й группе – на 89,3 % (рк < 0,05).
Сывороточная концентрация интерлейкинов при заболеваниях желудка (пг/мл)
|
Показатели |
Контрольная группа |
1-я группа |
2-я группа |
3-я группа |
4-я группа |
|
IL-1β |
3,81 ± 0,64 |
10,26 ± 2,04, рк < 0,001 |
9,01 ± 1,82, рк < 0,01 |
6,76 ± 1,63 |
11,15 ± 2,53, рк < 0,01 |
|
IL-2 |
2,56 ± 0,71 |
8,44 ± 1,86, рк < 0,01 |
10,49 ± 1,94, рк < 0,001 |
22,78 ± 5,38, рк < 0,001, р1 < 0,01, р2 < 0,05 |
18,07 ± 3,92, рк < 0,001, р1 < 0,05 |
|
IL-4 |
2,08 ± 0,53 |
3,67 ± 1,02 |
4,56 ± 1,08, рк < 0,05 |
4,75 ± 1,13, рк < 0,05 |
3,46 ± 0,98 |
|
IL-6 |
3,92 ± 0,78 |
6,45 ± 1,75 |
6,98 ± 1,32, рк≤0,05 |
5,32 ± 1,25 |
7,42 ± 1,51, рк < 0,05 |
|
IL-8 |
4,16 ± 0,82 |
14,47 ± 2,19, рк < 0,001 |
15,03 ± 3,10, рк < 0,001 |
7,46 ± 1,93 |
27,58 ± 5,52, рк < 0,001, р1 < 0,05, р2≤0,05, р3 < 0,001 |
|
IL-10 |
11,53 ± 1,69 |
13,52 ± 2,63 |
11,98 ± 2,04 |
14,42 ± 2,95 |
7,52 ± 1,46 |
|
IL-17 |
2,84 ± 0,65 |
6,25 ± 1,78 |
6,61 ± 1,2, рк < 0,01 |
10,8 ± 2,03, рк < 0,001 |
11,56 ± 1,72, рк < 0,001, р1 < 0,05, р2 < 0,05 |
|
IL-18 |
246,8 ± 20,61 |
304,1 ± 23,8 |
346,7 ± 32,5, рк < 0,01 |
392,4 ± 43,6, рк < 0,001 |
362,5 ± 27,4, рк < 0,001 |
Примечания: а) рк – статистически значимые различия при сравнении с контрольной группой; б) р1, р2, р3 – статистически значимые различия при сравнении с 1, 2, 3 группами больных соответственно.
Количество ИЛ-8 статистически значимо превышало средние значения контрольной группы (рк < 0,001) в 1-й, 2-й и 4-й группах. Наибольшие концентрации исследуемого медиатора определялись у больных язвенной болезнью желудка (рисунок). Значения ИЛ-8 в среднем по 4-й группе были достоверно больше, чем в группах сравнения: на 90,6 % относительно 1-й группы, на 83,5 % относительно 2-й группы, на 269,7 % относительно 3-й группы.
Сывороточный уровень ИЛ-10 у обследованных пациентов достоверно не отличался от значений контрольной группы, но, учитывая его значимость как противовоспалительного цитокина, следует отразить динамику изменений его концентрации. Количество ИЛ-10 увеличивалось в 1-й группе относительно средних цифр контрольной группы на 17,3 %, во 2-й группе – на 3,9 %, в 3-й группе – на 25,1 %, а в 4-й группе снижалось на 34,8 %.
Количество ИЛ-17 в сыворотке крови обследованных пациентов достоверно повышалось относительно средних значений контрольной группы во всех группах сравнения, статистически значимые различия наблюдались между 1-й, 2-й и 4-й группами. Значения ИЛ-17 в среднем по 4-й группе были больше цифр 1-й группы на 85 % (р1 < 0,05), на 74,9 % относительно 2-й группы (р2 < 0,05). Концентрация ИЛ-17 > 5 пг/мл определилась у 65,4 % больных: у 42,9; 75; 78,6; 65,6 % пациентов 1-й, 2-й, 3-й и 4-й групп соответственно.
Сывороточный уровень ИЛ-18 у обследованных пациентов повышался относительно средних значений контрольной группы в 1-й группе на 23,2 %, во 2-й, 3-й и 4-й группах – на 40,5 % (рк < 0,01), 58,9 % (рк < 0,001), 46,9 % (рк < 0,001) соответственно.
Увеличение сывороточной концентрации ранних провоспалительных цитокинов – ИЛ-1β, ИЛ-6, ИЛ-8, выявленное в 1-й, 2-й, 4-й группах больных, определяет выраженность воспалительного и ульцерозного процессов в СОЖ. Рядом ученых [9] показана способность ИЛ-1β, ИЛ-6 индуцировать на эндотелиоцитах экспрессию молекул адгезии, облегчающих миграцию моноцитов и нейтрофилов из сосудов в ткани. ИЛ-8, увеличивая внутриклеточную концентрацию Ca2+, может стимулировать эндотелиальную адгезию нейтрофилов и экстравазацию, приводить к их дегрануляции, выбросу лизосомальных ферментов, лейкотриенов, активных кислородных радикалов, повреждающих СОЖ [3, 6, 9]. Кроме того, возможна реализация ульцерозного действия глюкокортикостероидов, увеличение уровня которых опосредовано индукцией ИЛ-1β и способствует гиперсекреции соляной кислоты и пепсиногенов, уменьшению слизеобразования, ухудшению регенераторных процессов [10]. Важным механизмом повреждения является нарушение кровоснабжения слизистой под действием ИЛ-1β, ИЛ-8 за счет усиления свертывания крови, угнетения фибринолиза, развития тромбозов в микроциркуляторном русле и кровоизлияний в тканях [9]. Прогрессированию воспалительного процесса, атрофических изменений СОЖ, созданию условий для колонизации H. pylori может способствовать выраженное угнетение секреции соляной кислоты под действием ИЛ-1β и в меньшей степени ИЛ-17 [5, 14]. В то же время реализуются цитопротективные эффекты ИЛ-1β, ИЛ-6, ИЛ-8, ИЛ-17: индукция выработки простагландина Е2 (ПГE2) и серотонина, повышающих продукцию слизи и бикарбонатов в СОЖ [7, 14]. Установлено, что ИЛ-1β, ИЛ-17 могут стимулировать пролиферацию и дифференцировку миофибробластов, синтез в них металлопротеиназ, ПГE2, коллагеновых белков І, ІІІ типа [2].
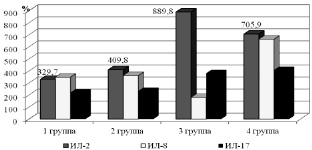
Наиболее выраженные изменения уровня интерлейкинов у обследованных (в %). Значения обследованных лиц контрольной группы приняты за 100 %
Выявленное во всех группах больных многократное увеличение ИЛ-2, медиатора пролиферации и дифференцировки Т-лимфоцитов, максимальное при распространенном атрофическом гастрите, может способствовать как индукции повреждающего действия цитотоксических лимфоцитов, так и реализации противоопухолевого эффекта, что особенно актуально в условиях дисплазии СОЖ. В то же время имеются данные о стимуляции ИЛ-2 продукции гастрина и гистамина клетками слизистой, что усиливает кислото- и пепсинообразование, уменьшает продукцию гастромукопротеидов [10]. С другой стороны, индуцированная ИЛ-1, ИЛ-2 секреция гастрина, ацетилхолина может повышать Са2 + в клетках СОЖ, способствуя увеличению количества цГМФ и активации синтеза ДНК, тем самым клеточной пролиферации; последующее накопление цАМФ стимулирует дифференцировку клеток [7].
Наименьший уровень ИЛ-18 отмечался у больных 1-й группы и отражал минимальную (относительно других групп) выраженность воспалительного процесса в СОЖ (согласно гистологической картине биоптатов). Ранее установлено [15], что ИЛ-18 может способствовать выраженной инфильтрации СОЖ моноцитами, блокировать активацию T-хелперов 2-го типа, что сопровождается низким уровнем ИЛ-4. Показано также, что усиление синтеза ИЛ-18 приводит к блокированию роста и пролиферации эндотелиоцитов, угнетению ангиогенеза, останавливает формирование новых сосудов, регрессирует растущие сосуды [13]. Выявленные эффекты действия на фоне максимальной концентрации медиатора у больных распространенным атрофическим гастритом можно интерпретировать двояко: с одной стороны, угнетение ангиогенеза затрудняет регенерацию СОЖ, с другой, препятствует канцерогенезу.
Способностью ИЛ-18 угнетать продукцию и активность ИЛ-1β [11], а также действием противовоспалительных цитокинов можно объяснить минимальные в 3-й группе (относительно других групп сравнения) значения ИЛ-1β, ИЛ-6, ИЛ-8. ИЛ-4 и ИЛ-10 могут ингибировать цитотоксичность макрофагов и секрецию нейтрофилами ИЛ-1β и других провоспалительных цитокинов за счет уменьшения специфичных мРНК на поздней стадии процесса активации нейтрофилов [8], стимулировать ангиогенез [11], индуцировать рост и дифференцировку фибробластов [5].
Таким образом, увеличение концентрации ИЛ-1β, ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-17, ИЛ-18 способствует реализации воспалительного, ульцерозного и атрофического процессов в СОЖ с постепенным компенсаторным включением цитопротективных и репаративных механизмов. Количество ИЛ-4 и ИЛ-10 в фазе обострения воспалительного и особенно ульцерозного процессов минимально, нарастает при прогрессировании атрофии СОЖ, ограничивая действие провоспалительных цитокинов и усиливая репарацию слизистой. Учитывая каскадность активации и плейотропность цитокинов, для адекватной оценки течения заболеваний гастродуоденальной зоны желательно одновременное определение сывороточных концентраций про- и противовоспалительных интерлейкинов с проецированием на иммунный статус конкретного пациента.
Рецензенты:
Котляров А.А., д.м.н., профессор, зав. кафедрой внутренних болезней, ФГАОУ ВПО «НИЯУ «МИФИ», г. Обнинск;
Столярова В.В., д.м.н., профессор кафедры госпитальной терапии ФГБОУ ВПО «МГУ им. Н. П. Огарева», г. Саранск.
Работа поступила в редакцию 07.05.2013.



