В настоящее время наибольший интерес представляют многокомпонентные наноразмерные материалы, обладающие широким спектром функциональных свойств [5, 6, 9]. Известно [10] использование нановолокнистого оксогидроксида алюминия (AlOOH) в качестве сорбента для очистки воды от вирусов и бактерий. Несмотря на высокую удельную поверхность этого материала, достигающую значений 300 м2/г, широкого практического применения он не нашел. Для расширения функциональных свойств оксогидроксида алюминия необходим поиск путей придания ему новых свойств, что можно осуществить путем модифицирования. Для наноматериалов с высокой площадью удельной поверхностью обычно применяется поверхностное модифицирование [4].
Целью настоящей работы является исследование физико-химических и функциональных свойств модифицированных нановолокон оксогидроксида алюминия.
Выбор ионов марганца (II) обусловлен его каталитическим действием в процессе разложения пероксида водорода, окисления двухвалентного железаи синтеза органических соединений [1, 6, 7].
Материалы и методы исследования
В качестве исходного материала для получения нановолкон AlOOH использовали нанопорошок алюминия, полученный методом электрического взрыва проводника в среде аргона с добавлением кислорода из расчета 0,05 г на 1 г алюминиевой проволоки. Такие условия позволили получить пассивированные порошки с содержанием активного алюминия не менее 85 мас. %.
Метод получения нановолокнистого оксогидроксида алюминия основан на реакции окисления нанопорошка алюминия водой [2]. Окисление проводили в дистиллированной воде и в водном растворе соли сульфата марганца (MnSO4·5H2O). Методика модифицирования изложена в работе [3] и заключалась в совместном протекании процессов роста нановолокон AlOOH и модифицирования. Концентрация нанопорошка алюминия сохранялась постоянной и составляла 13,9·10–3 М, а содержание ионов Mn2+ в растворе изменяли в диапазоне от 0,02·10–3 до 19,3·10–3 М.
Количественное содержание ионов Mn2+ в модифицированных нановолокнах определяли методом химического анализа в соответствии с ГОСТ 4974-72. Синтезированные образцы отмывали дистиллированной водой, растворяли в 5 мл концентрированной азотной кислоты и проводили количественный химический анализ на содержание ионов Mn2+ в образцах.
Площадь удельной поверхности измеряли с помощью анализатора «Сорбтометр-М» методом БЭТ, а фазовый состав контролировали методом рентгеновского анализа с использованием дифрактометра Shimadzu XRD-7000. Диапазон углов сканирования 2θ составлял от 10 до 70 град., а скорость сканирования поддерживалась 1 град./мин.
Функциональные свойства модифицированных образцов с различным содержанием марганца исследовали в статических условиях в реакциях разложения пероксида водорода и окислении двухвалентного железа. Эффективность разложения пероксида водорода в присутствии модифицированных образцов с разным содержанием ионов марганца исследовали волюмометрическим методом с использованием уравнения Менделеева‒Клайперона. Концентрация пероксида водорода в растворе была постоянной и составляла 0,54 мас. %. Для оценки эффективности окисления железа (II) в присутствии модифицированных образцов контролировали концентрацию железа (II) в растворе колориметрическим методом с о-фенантролином [8]. Исходная концентрация железа (II) составляла 12,0 ± 1,2 мг/л.
Результаты исследования и их обсуждение
Взаимодействие электровзрывного нанопорошка алюминия с водой протекало по реакции:
2Al + 5H2O→AlOOH + Al(OH)3 + 3H2 (1)
Продуктами реакции являлись гидроксид алюминия – Al(OH)3, оксогидроксид алюминия – AlOOH и небольшое количество металлического алюминия, не вступившего в реакцию. При взаимодействии нанопорошка алюминия с водным раствором соли марганца изменялся химический и фазовый состав продуктов реакции, что свидетельствовало об участии ионов Mn2+ в формировании нановолокон. Влияние концентрации ионов марганца в растворе на площадь удельной поверхности и содержание активного алюминия в образующихся нановолокнах представлено в таблице.
Зависимость значения удельной поверхности и активного алюминия модифицированных образцов от концентрации прореагировавшего марганца
|
Номер образца |
Исходная концентрация марганца в растворе, 10–3 М |
Концентрация прореагировавшего марганца, 10–3 М |
Доля прореагировавшего марганца, % |
Значение площади удельной поверхности, м2/г |
Концентрация активного алюминия, мас. % |
|
0 |
0 |
0 |
0 |
215 |
0,4 |
|
1 |
0,02 |
0,019 |
98,0 |
268 |
0,5 |
|
2 |
1,13 |
0,41 |
36,3 |
236 |
0,8 |
|
3 |
11,66 |
2,71 |
23,3 |
136 |
2,7 |
|
4 |
19,3 |
4,01 |
20,78 |
106 |
3,6 |
Из таблицы видно, что при увеличении концентрации ионов марганца в растворе увеличивалась концентрация марганца, участвующего в процессе модифицирования, в то время как его доля по отношению к исходной концентрации снижалась. Это связано с уменьшением интенсивности образования волокнистой структуры при увеличении концентрации ионов Mn2+ в растворе, что показано результатами по измерению площади удельной поверхности и остаточной концентрации активного алюминия в модифицированных образцах. Результаты, представленные в таблице, согласуются с результатами рентгенофазового анализа, приведенными на рис. 1.
Из рис. 1 видно, что основными фазами в исходном образце (0) являлись псевдобемит AlOOH, байерит Al(OH)3 и небольшое количество металлического алюминия (менее 0,5 мас. %, полученный волюмометрическим методом). С увеличением концентрации марганца в модифицированных образцах (1, 2, 3, 4) интенсивность пиков, характеризующих фазы псевдобемита и байерита, снижается, а доля металлического алюминия увеличивается, что наиболее ярко проявляется в образце 4 с содержанием марганца, равным 8,47∙10–3 мг/мг (получено аналитическим метод).
Известно, что окисление нанопрошка алюминия, полученного методом электрического взрыва проводника в среде аргона, протекает в три стадии. Первой стадией является индукционный период, где происходит адсорбция молекул воды на пассивирующем слое наночастиц порошка алюминия с последующей гидратацией. Вторая стадия заключается в диффузии молекул воды к поверхности активной частицы алюминия и протекании реакции окисления, сопровождающейся выделением водорода по реакции (1). Количество выделяющегося водорода эквивалентно количеству алюминия, вступившего в реакцию с водой. На третьей стадии идет процесс формирования проницаемого для воды псевдобемита, имеющего волокнистую структуру, и гидроксида алюминия. Однако в растворах солей данный механизм меняется. Была определена некоторая пороговая концентрация ионов Mn2+ в растворе, равная 12·10–3 М, значение которой определяет механизм взаимодействие нанопорошка алюминия с раствором соли марганца. При концентрации ионов Mn2 + в растворе менее указанного значения, на второй стадии преимущественно протекает реакция окисления металлического алюминия водой и выделение водорода:
Al0 – 3e → Al3+ (2)
2H2O + 2e → H2 + 2OH– (3)
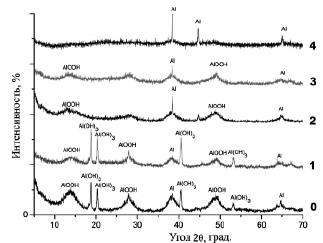
Рис. 1. Рентгенограммы исходного – 0 и модифицированных – 1, 2, 3, 4, образцов оксогидроксида алюминия
При накоплении ионов Al3+ и OН–до значений произведения растворимости формируются новые фазы в виде нановолокон состава AlOOH и Al(OH)3, содержащие марганец в своей структуре, что связано с соосаждением в процессе роста нановолокон. При концентрациях ионов Mn2+ выше порогового значения механизм взаимодействия нанопорошка алюминия с раствором соли марганца меняется ввиду участия ионов марганца в процессе модифицирования по реакции:
Mn2+ + 2e → Mn0, (4)
которая является конкурирующей по отношению к реакции 3 на второй стадии, что приводит к снижению интенсивности образования нановолокон и увеличению содержания остаточного активного алюминия в образцах. Это связано с эффектом частичной пассивации поверхности наночастиц алюминия продуктом реакции 4. Благодаря высокой активности алюминия и марганца в водном растворе возможно их взаимодействие с образованием нестехиометрических соединений со структурой шпинелиевого типа – MnOх·Al2O3. Из литературы известно, что соединения такого типа могут обладать каталитическими свойствами, что было исследовано в реакции окисления ионов Fe (II). Для каждого модифицированного образца были получены зависимости изменения концентрации ионов Fe (II) от времени окисления, что показано на рис. 2 и 3.
Из рис. 2 и 3 видно, что процесс окисления железа (II) протекал более интенсивно в присутствии модифицированных нановолокон AlOOH в сравнении с немодифицированными образцами. Снижение концентрации ионов Fe2+ в растворе в присутствии немодифицированных образцов объясняется самопроизвольным его окислением в воздухе. Наибольшую эффективность процесса окисления железа (II) – 93,2 % показал образец 1, обладающий наибольшей площадью удельной поверхности, которая является определяющей в протекании гетерогенной реакции образования нерастворимого Fe(OH)3. Полученные экспериментальные результаты по изменению концентрации ионов Fe2+ в присутствии модифицированных образцов позволили рассчитать константы скорости процессов для различной концентрации ионов марганца в модифицированных образцах: k = 34·10–5 c–1, k0 = 35·10–5 c–1, k1 = 61·10–5 c–1, k2 = 54·10–5 c–1, k3 = 52·10–5 c–1, k4 = 55·10–5 c–1, которые показали, что скорость окисления возрастает в 1,8 раз.
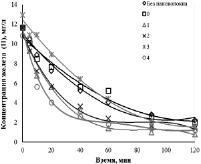
Рис. 2. Кинетика окисления железа (II) в присутствии модифицированныхнановолокон AlOOH
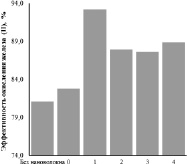
Рис. 3. Зависимость эффективности окисления железа (II) от содержания марганца в модифицированных нановолокнах AlOOH
Каталитические свойства модифицированных нановолокон AlOOH оценивались также в реакции разложения пероксида водорода. Эксперименты проводили при температуре 20–26 °С и атмосферном давлении, которые учитывались в уравнении Менделеева–Клайперона при расчете количества разложившегося пероксида водорода. Полученные результаты представлены на рис. 4.
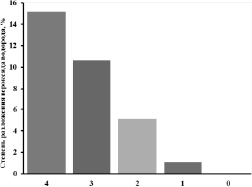
Рис. 4. Зависимость степени разложения пероксида водорода от содержания марганца в модифицированных нановолокнах AlOOH
Из рис. 4 видно, что на процесс разложения пероксида водорода исходный оксогидроксид алюминия не оказывает каталитического действия. Модифицированные образцы катализируют процесс разложения пероксида водорода, причем степень разложения увеличивается с ростом содержания марганца в образцах.
Выполненные в работе эксперименты показали, что процесс модифицирования оксогидроксида алюминия ионами Mn2+ приводит к получению материала с новыми функциональными свойствами, проявляющимися в каталитических реакциях, что открывает новые области применения этого материала.
Выводы
1. Показано, что модифицирование нановолокон оксогидроксида алюминия приводит к изменению химического и фазового состава полученного материала.
2. Предложен механизм, отражающий влияние концентрации ионов Mn2+ на формирование структуры модифицированных образцов.
3. Исследованы каталитические свойства модифицированных образцов в реакциях разложения пероксида водорода и окисления ионов железа (II). Установлено, что каталитические свойства возрастают с увеличением содержания ионов марганца в модифицированных образцах, что связано с изменением их состава в процессе модифицирования.
В работе использованы результаты, полученные на оборудовании центра коллективного пользования «Нано-центр ТПУ».
Работа выполнена в рамках государственного задания «Наука» по теме 3.2702.2011.
Рецензенты:
Асламова В.С., д.т.н., профессор кафедры безопасности жизнедеятельности и экологии, ФГБОУ ВПО «Иркутский государственный университет путей сообщения», г. Иркутск;
Ивашкина Е.Н., д.х.н., доцент кафедры химической технологии топлива и химической кибернетики, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.



