Иодпиридины представляют большой синтетический интерес в качестве исходных продуктов во многих превращениях[7–6]. Однако методы их синтеза ограничены в связи с известной инертностью пиридинов в реакциях электрофильного замещения. Чаще всего используется прямое ипсо-замещение брома или хлора в соответствующих пиридинах на йод [3], иододебромирование через предварительное металлирование [2–9]. Диазотирование в растворах минеральных кислот, как правило, малопригодно для аминопиридинов; проведение этой реакции в неводных средах требует использования токсичных алкилнитритов, зачастую медных катализаторов, но и эти условия далеко не всегда обеспечивают удовлетворительные выходы иодпиридинов [4]. Недавно нами показано, что анилины успешно превращаются в арилиодиды под действием системы p-TsOH/NaNO2/KI в ацетонитриле [5]. Реакция гладко протекает с 3-аминопиридинами, однако 2- и 4-аминопиридины образуют N-ацил- и тозильные производные – продукты взаимодействия с ацетонитрилом и п-толуолсульфокислотой.
Таким образом, цель данной работы – поиск условий для синтеза труднодоступных иодпиридинов через диазотирование – иодирование аминопиридинов.
Результаты исследования и их обсуждение
В качестве модельного субстрата был выбран 2-амино-5-бромпиридин (1). В качестве альтернативных растворителей исследовались метанол, этанол, трет-бутанол, кислотных компонентов реакции – трифторметансульфокислота, фосфорная кислота.
Было показано, что метанол и этанол малопригодны для диазотитрования-иодирования (низкая конверсия исходного аминопиридина 1, образование нежелательных продуктов восстановления). Наилучшие результаты были получены при использовании трет-бутилового спирта в качестве растворителя реакции диазотирования-иодирования аминопиридина 1, выход желаемого 5-бром-2-иодпиридина (1а) составил 32 % (данные ГХ-МС), однако 5-бромпиридин-2-ил-4-метилбензолсульфонат (1б), продукт побочного взаимодействия с п-толуолсульфокислотой, по-прежнему оставался преобладающим.
Основным недостатком при использовании трифторметансульфокислоты в качестве альтернативы п-толуолсульфокислоте при диазотировании-иодировании аминопиридина 1 оказалось протекание побочного алкилирования (схема 1) с образованием 5-бром-N-(трет-бутил) пиридин-2-амина (1в).
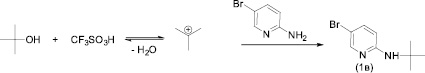
Схема 1
Мы показали, что аминопиридин 1 под действием системы NaNO2/KI/H3PO4 в трет-бутаноле в течение 5 ч при 40 °С превращается в соответствующее иодпризводное 1а с препаративным выходом 58 %. Было найдено наиболее оптимальное мольное соотношение реагентов: субстрат: NaNO2:KI:H3PO4 1:2,5:3:5.
Найденные условия мы использовали для диазотирования-иодирования ряда аминопридинов (1 – 9) и некоторых аминобензтиазолов (10–12) (схема 2, таблица).
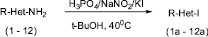
Схема 2
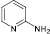
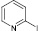
Было показано, что во всех случаях достигается полная конверсия исходных аминогетероциклов (1–12). 2-, 4-Аминопиридины (2, 5) и аминопиколины (8, 9) продемонстрировали низкую реакционную способность в исследуемом процессе (таблица). При этом в случае аминопиридинов (2, 5, 8) основными продуктами оказались соответствующие гидроксипиридины, зафиксированные методами ГХ-МС и ВЭЖХ. Полученные результаты согласуются с известными литературными данными о диазотировании этих соединений [1]: в водных растворах минеральных кислот в результате диазотирования-иодирования 2-, 4-аминопиридинов преимущественно образуются соответствующие гидроксипроизводные.
Тем не менее следует указать, что выходы иодпиридинов 2а, 5а превышают таковые, полученные ранее при использовании системы p-TsOH/NaNO2/KI в ацетонитриле [5], а 2,5-дииод-4-метилпиридин (9а) синтезирован впервые. Диазотиорвание-иодирование галогенсодержащих 2-аминопиридинов (1, 6, 7) происходит достаточно быстро, хотя и в этом случае зафиксировано побочное образование соответствующих гидроксипиридинов (таблица).
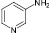
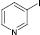
3-Аминопиридины (3, 4) под действием H3PO4/NaNO2/KI в трет-бутаноле превращались в соответствующие иодпиридины (3а, 4а) с более высокими выходами, чем это было достигнуто ранее при использовании других диазотирующих систем [5].
Диазотирование-иодирование аминобензтиазолов (10–12) в описываемых условиях обеспечило практически количественные выходы иодбензтиазолов (10а–12а), в том числе ранее не известных (11а, 12а).
Таким образом, нами показано, что труднодоступные иодпиридины и иодбензтиазолы могут быть с успехом получены реакцией диазотирования-иодирования соответствующих аминогетероциклов в слабокислотных неводных средах под действием системы H3PO4/NaNO2/KI/ трет-бутанол.
Материалы и методы исследования
1. Приборы и оборудование
Спектры ЯМР 1Н, 13С записывали на спектрометре Bruker AC-300 (300 МГц), внутренний стандарт – ТМС, растворитель указан в тексте. Анализ ГХ-МС проводили на газовом хроматографе Agilent с квадроупольным масс-детектором (ЭУ, 70 эВ), газ-носитель – гелий. Анализ ВЭЖХ проводили на жидкостном хроматографе Agilent с УФ-детектором, длина волны 280 нм. Колонка EclipsePlusC18, 5 нм, 4,6×150 мм. Элюенты: вода: 0,1 % CF3COOH (А), ацетонитрил: 0,1 % CF3COOH (В). Градиент: 0–15 мин 100 % А, 15–20 мин. до 10 % В, 20–30 мин до 100 % В. Температура плавления определялась на приборе Boetius. Пробы смешения полученных соединений с известными образцами депрессии температуры плавления не дают.
Диазотирование-иодирование аминопиридинов (1–9) и аминобензтиазолов (10–12) системой H3PO4/NaNO2/KI в трет-бутаноле при 40 °С, мольное соотношение субстрат:NaNO2:KI:H3PO4 1:2,5:3:5
|
Субстрат |
Время, ч. |
Продукт |
Выход, % |
Тпл (Тпллит.), ᴼС |
|
|
5 |
|
52 |
112 |
|
|
24 |
|
35 |
Масло |
|
|
2 |
|
71 |
50–51 (52–53[8]) |
|
|
1 |
|
80 |
93 (93,5–95 [8]) |
|
|
24 |
|
30 |
101–102 (98 –100 [9]) |
|
|
1,5 |
|
57 |
82–84 |
|
|
6 |
|
52 |
72–74 |
|
|
23 |
|
34 |
Масло |
|
|
24 |
|
60 |
94 |
|
|
3 |
|
96 |
80–81 (79–80 [8]) |
|
|
1 |
|
97 |
99–101 |
|
|
1 |
|
78 |
115–116 |
Контроль за ходом реакции и чистотой полученных продуктов вели методом ТСХ на пластинках Silufol UV-254. Детектирование пятен проводили УФ-светом. Очистку продуктов осуществляли с помощью флеш-хроматографии на колонках 15×1 см, сорбент Silicagel L (40/100 μ), элюент ‒ гексан.
2. Общая методика диазотирования-иодирования гетероциклических аминов (1–12): к раствору 2 ммоль гетероциклического амина в 8 мл трет-бутанола добавляли 10 ммоль фосфорной кислоты при комнатной температуре и по каплям раствор 5 ммоль NaNO2 и 6 ммоль KI в 1 мл воды. Реакционная смесь нагревалась до 40 °С и выдерживалась при данной температуре и перемешивании до полного исчезновения исходного субстрата (ТСХ). По завершении реакции смесь разбавлялась 50 мл воды, обрабатывалась 10 % раствором Na2SO3, и 10 % раствором Na2CO3 до pH = 9. Осадок отфильтровывали и промывали водой, жидкие продукты экстрагировали метиленхлоридом. Полученные продукты очищали флеш-хроматографией на силикагеле, элюент – гексан. Время реакции и выходы продуктов указаны в таблице.
5-бром-2-иод пиридин (1а). Выход 52 %, Тпл 112 °С. 1H ЯМР (300МГц, CDCl3) δ м.д.: 7,5 (д, J = 2,8, 1H), 7,6 (д, J = 8,4, 1H), 8,5 (д, J = 2,8, 1H). 13C ЯМР (75МГц, CDCl3): δ 115; 121; 136; 140; 152. МС m/z: 283 (М+, 71), 256 (2), 208 (1), 176 (2), 156 (100), 127 (20), 106 (5), 76 (54), 50 (32).
2-иодпиридин (2а). Выход 35 %, масло. 1H ЯМР (300 МГц, CDCl3) δ м.д.: 7,2–7,3 (м, 2H), 7,7 (д, J = 7,5, 1H), 8,4 (д, J = 3, 1H). 13C ЯМР (75МГц, CDCl3): δ 118; 123; 135; 138; 151. МС m/z: 205 (М+, 90), 177 (1), 152 (2), 139 (1), 127 (16), 102 (2), 78 (100), 51 (31), 39 (4).
4-иодпиридин (5а). Выход 30 %, Тпл 101–103 °С. 1H ЯМР (300МГц, CDCl3) δ м.д.: 6,5 (д, J = 6, 2H), 8,2 (д, J = 2, 2H). 13C ЯМР (75МГц, CDCl3): δ 110; 150; 153. МС m/z: 205 (М+, 100), 177 (4), 152 (3), 127 (12), 102 (5), 78 (46), 51 (27), 37 (2).
2-иод-5-хлорпиридин (6а). Выход 57 %, Тпл 82–84 °С. 1H ЯМР (300 МГц, CDCl3): δ 7,2–7,3 (м, 1H), 7,6 (д, J = 8,4, 1H), 8,3 (д, J = 2,7, 1H). 13C ЯМР (75 МГц, CDCl3): δ 114; 133; 136; 138; 150. МС m/z: 239 (М+, 88), 211 (1), 208 (1), 176 (2), 152 (2), 127 (15), 112 (100), 86 (8), 76 (46), 62 (3), 50 (13), 38 (2).
3,5-дибром-2-иодпиридин (7а). Выход 52 %, Тпл 72–74 °С. 1H ЯМР (300 МГц, CDCl3): δ 8,0 (д, J = 2,1, 1H), 8,4 (д, J = 2,1, 1H). 13C ЯМР (75 МГц, CDCl3): δ 120; 122; 130; 142; 149. МС m/z: 363 (М+, 88), 256 (1), 235 (100), 208 (3), 176 (5), 156 (31), 127 (27), 106 (6), 76 (47), 49 (12).
2-иод-3-метилпиридин (8а). Выход 34 %, масло. 1H ЯМР (300 МГц, CDCl3) δ м.д.: 2,4 (с, 3H) 7,1–7,2 (м, 2H), 7,4 (д, J = 7,5, 1H), 8,1 (д, J = 4,2, 1H). 13C ЯМР (75 МГц, CDCl3): δ 26; 123; 125; 137; 139; 148. МС m/z: 219 (М+, 86), 177 (1), 153 (2), 127 (21), 92 (100), 65 (50), 39 (12).
2,5-дииод-3-метилпиридин (9а). Выход 60 %, Тпл 94 °С. 1H ЯМР (300 МГц, CDCl3) δ м.д.: 2,3 (с, 3H), 7,6 (с, 1H), 8,6 (с, 1H). 13C ЯМР (75 МГц, CDCl3): δ 27; 101; 117; 136; 152; 157. МС m/z: 345 (М+, 100), 254 (1), 218 (94), 191 (6), 152 (2), 127 (14), 91 (45), 64 (26), 39 (6).
2-иод-5-метилбензтиазол (11а). Выход 97 %, Тпл 99–101 °С. 1H ЯМР (300 МГц, CDCl3) δ м.д.: 2,5 (с, 3H) 7,3 (д, J = 8,4, 1H), 7,8 (д, J = 6,3, 1H). 13C ЯМР (75 МГц, CDCl3): δ 21; 109; 120; 121; 128; 135; 139; 152. МС m/z: 275 (М+, 100), 234 (2), 219 (1), 189 (1), 165 (1), 148 (19), 138 (5), 133 (3), 127 (4), 107 (5), 93 (1), 88 (1), 81 (2), 74 (3), 69 (4), 63 (15), 57 (5), 50 (3).
2-иод-5-метоксибензтиазол (12а). Выход 78 %, Тпл 115–116 °С. 1H ЯМР (300 МГц, CDCl3) δ м.д.: 3,8 (с, 3H) 7,0 (д, J = 7,5, 1H), 7,9 (д, J = 9, 1H). 13C ЯМР (75 МГц, CDCl3): δ 56; 104; 107; 116; 122; 140; 149; 158. МС m/z: 291 (М+, 100), 276 (48), 249 (15), 171 (3), 149 (5), 121 (15), 94 (5), 69 (7), 45 (2).
Работа выполнена в рамках государственного задания «Наука» по теме 3.2702.2011.
Рецензенты:
Короткова Е.И., д.х.н., профессор кафедры физической и аналитической химии, заместитель директора по научной работе и инновационному развитию Института природных ресурсов, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск;
Слепченко Г.Б., д.х.н., профессор кафедры физической и аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.



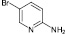 (1)
(1)
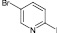 (1а)
(1а)
 (2)
(2)
 (2а)
(2а)
 (3)
(3)
 (3а)
(3а)
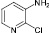 (4)
(4)
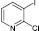 (4а)
(4а)
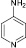 (5)
(5)
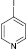 (5а)
(5а)
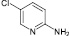 (6)
(6)
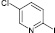 (6а)
(6а)
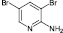 (7)
(7)
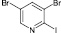 (7а)
(7а)
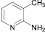 (8)
(8)
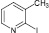 (8а)
(8а)
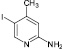 (9)
(9)
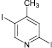 (9а)
(9а)
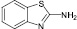 (10)
(10)
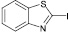 (10а)
(10а)
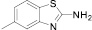 (11)
(11)
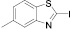 (11а)
(11а)
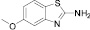 (12)
(12)
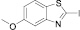 (12a)
(12a)