Одним из информативных и быстрых методов исследования цитогенетических повреждений является микроядерный тест, основанный на подсчете числа клеток микроядрами, которые являются показателем воздействия на организм генотоксических факторов внешней среды. Для этих целей используются эритроциты или другие высокоспециализированные клетки живых организмов [3 и др.].
В настоящее время микроядерный тест включен как обязательный при токсикологических исследованиях, особенно в промышленном рыбоводстве. Данный метод широко применяется при оценки гомеостаза организма. Такие работы проведены на рыбах, мышах, крысах, лягушках, голубях, ящерицах, гадюках [2, 5, 6, 11, 13 и др.]. Подобные исследования в области сельского хозяйства в научной литературе слабо освещены. В то же время регистрация эритроцитов периферической крови с микроядрами может служить показателем физиологического состояния организма и потенциальной генотоксичности внешней среды [1, 9, 16].
Относительно новой областью птицеводства является перепеловодство. Его развитие связано с высокой продуктивностью и скороспелостью данного вида птицы, что стимулирует исследования в области морфологии, физиологии и биохимии [12].
Правильно осуществляемые технологические приемы по выращиванию и разведению перепелов не должны нарушать гомеостаз организма [10]. Поэтому необходимо проводить оценку стабильности генетического материала при промышленном разведении перепелов, что представляет особый интерес с позиции выяснения эффективности применения технологии выращивания и разведения. Для решения данной проблемы можно применить микроядерный тест в эритроцитах крови.
Рядом авторов показано влияние способа окрашивания материала на результаты микроядерного теста [4, 15 и др.]. Поэтому важной методологической задачей, решаемой при проведении микроядерного теста, является подбор оптимального способа окрашивания, позволяющего получить качественные препараты для исследования и выявить максимальное количество аберрантных клеток. В связи с чем целью работы явился выбор оптимального способа окрашивания эритроцитов периферической крови перепела японского для проведения микроядерного теста.
Материалы и методы исследования
Исследования проводились в ОАО «Воронежское перепелиное хозяйство» (с. Новая Усмань Воронежской области). Объектом исследования служили перепела японские в возрасте 68 дней.
Для приготовления препаратов (1 особь – 1 препарат) кровь брали из яремной вены, наносили на чистое сухое предметное стекло (делали мазок), фиксировали в 96- % этиловом спирте 1-2 минуты. Сухие препараты окрашивали разными красителями:
1. Отфильтрованный водный раствор азур-эозина по Романовскому–Гимза (1:5) наносили на препарат и выдерживали 20 мин при комнатной температуре, затем накрывали препарат покровными стеклами и убирали излишки красителя фильтровальной бумагой.
2. Отфильтрованный 1 %-й раствор орсеина наносили на препарат на 20 мин, затем накрывали покровными стеклами и убирали излишки красителя фильтровальной бумагой. Вся работа должна проводиться в вытяжном шкафу, так как в состав данного красителя входит уксусная кислота.
3. Спиртовой раствор метиленового синего наносили на препарат на 5 минут, сливали краситель и подсушивали на воздухе, затем наносили иммерсионное масло и накрывали покровным стеклом.
4. Отфильтрованный 1 %-й раствор орсеина наносили на препарат на 5 мин, смывали краситель дистиллированной водой и на несколько секунд наносили 0,1 %-й спиртовой раствор светлого зеленого, сливали краситель и подсушивали на воздухе, затем наносили иммерсионное масло и накрывали покровным стеклом.
Выбор данных красителей обусловлен тем, что первый является цитоплазматическим, а остальные – ядерными. При комбинированной окраске (орсеин и светлый зеленый) последний использовали для подкраски.
Препараты анализировали на микроскопе LABOVAL-4 (Carl Zeiss, Jena) при увеличении 100×1,5×10. Было просмотрено 40 препаратов (10 по каждому красителю), на каждом подсчитывали не менее 1000 клеток и вычисляли частоту встречаемости эритроцитов с микроядрами как отношение числа клеток с микроядрами к общему числу проанализированных клеток (в ‰). Всего было проанализировано 46583 клеток. Для анализа возможных половых различий по частоте эритроцитов с микроядрами материал для анализа брали от 5 самок и 5 самцов.
Статистическую обработку данных проводили с помощью пакета статистических программ «Stadia». Процедура группировки данных и их обработка изложены в работе Кулаичева [7]. Сравнение медиан выборок осуществляли с использованием непараметрического Х–критерия Ван-дер-Вардена. Для выявления влияния красителя и пола использовали двухфакторный дисперсионный анализ с фиксированными эффектами. Силу влияния вычисляли по Снедекору (в %). Рассеяния признаков в выборках сравнивали с использованием критерия Ансари–Бредли. Коэффициент вариации (Cv) определяли согласно рекомендациям Лакина [8].
Результаты исследований и их обсуждение
При окраске азур-эозином по Романовскому–Гимза, метиленовым синим и орсеином получаются однородно окрашенные чистые препараты, на которых ядерный аппарат по окраске отличается от цитоплазмы, клетка имеет четкие границы (рис. 1).
При окрашивании светлым зеленым получаются грязные, неоднородно окрашенные препараты, методика окрашивания сложнее, чем при использовании остальных красителей, так как использование двух красителей не очень удобно.
В результате проведенных исследований в эритроцитах периферической крови перепелов при разных способах окраски обнаружены клетки с микроядрами (рис. 2).
В результате проведенных исследований установлено влияние красителя (сила влияния – 3,8 % (P < 0,001)) и совместное действие красителя и пола (сила влияния – 17,4 % (P < 0,05)) на частоту обнаружения эритроцитов с микроядрами в периферической крови перепела японского.
Наибольшая частота встречаемости клеток с микроядрами отмечается при окраске орсеином (2,44 ± 0,26 ‰), наименьшая – светлым зеленым (0,74 ± 0,17 ‰) (P < 0,001) (рис. 3). Ранее выполненные исследования влияния клеточного красителя на частоту обнаружения клеток с ядерными аномалиями в буккальном эпителии человека показали, что наибольшее количество клеток с микроядрами выявлено при окраске азур–эозином по Романовскому–Гимза, а наименьшее – светлым зеленым [4].
При окраске азур-эозином по Романовскому–Гимза уровень эритроцитов с микроядрами у разных особей варьировался от 0,58 до 3,53 ‰ (Cv = 67,1 %) при среднем значении 1,58 ± 0,33 ‰. При использовании орсеина количество эритроцитов с аберрацией колебалось от 0,81 до 3,53 ‰ (Cv = 34,3 %) при средней величине исследуемого показателя 2,44 ± 0,26 ‰. Использование в качестве красителя метиленовой сини позволило зарегистрировать изменение величины клеток с микроядрами в крови перепела от 0,74 до 1,74 ‰ (Cv = 11 %) при среднем значении данного показателя 0,87 ± 0,03 ‰. Подкраска светлым зеленым показала колебание изученного показателя от 0 до 1,88 ‰ (Cv = 71,2 %) при среднем значении данной характеристике 0,74 ± 0,17 ‰.
Сравнив коэффициенты вариации, а также вариабельность полученных данных, мы можем говорить о том, что применение орсеина и метиленового синего дает наименьший разброс значений изученного показателя. Причем рассеивание значений при использовании метиленовой сини статистически достоверно ниже, чем рассеивание значений при использовании в качестве красителя азур–эозин по Романовскому–Гимза и светлого зеленого (P < 0,01 и P < 0,05 соответственно), т.е. при использовании этих красителей нивелируется индивидуальная компонента, связанная с особенностями окрашивания эритроцитов периферической крови у разных особей.
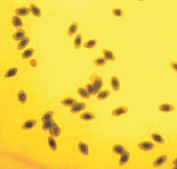
Азур–эозин по Романовскому–Гимза
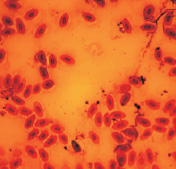
Орсеин
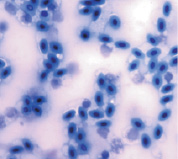
Метиленовый синий
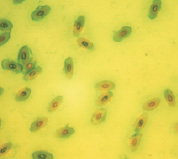
Светлый зеленый
Рис. 1. Эритроциты перепела при разных способах окрашивания. Объектив 40х, гомаль 1,5х, окуляр 10х
Таким образом, на основании полученных результатов можно рекомендовать окрашивание орсеином как наиболее оптимальноe при проведении микроядерного теста в эритроцитах периферической крови перепела японского, так как данный способ окраски позволяет выявить наибольшее число эритроцитов с микроядрами и имеет относительно невысокий разброс значений признака исследуемого показателя.
Различия между полами по частоте встречаемости аберрантных эритроцитов установлены при окраске азур-эозином по Романовскому–Гимза и светлым зеленым (P < 0,05 и P < 0,01 соответственно) (рис. 4).
При окраске ядерными красителями (орсеин, метиленовый синий и светлый зеленый) наибольшее число эритроцитов с микроядрами отмечается у самцов, цитоплазматическими (азур-эозин по Романовскому–Гимза) – у самок.
Окраска азур–эозином по Романовскому–Гимза показала колебание числа эритроцитов с микроядрами у самок от 0,82 до 2,83 ‰ (Cv = 57,4 %) при среднем значении 2,09 ± 0,54 ‰, у самцов – от 0,58 до 1,83 ‰ (Cv = 59,81 %) при среднем значении 1,06 ± 0,28 ‰. При окраске мазков крови орсеином изменение выявляемых нарушений составило у самок от 0,81 до 3,33 ‰ (Cv = 42,2 %) при среднем значении 2,32 ± 0,44 ‰, у самцов – от 1,76 до 3,53 ‰ (Cv = 29,84 %) при среднем значении 2,56 ± 0,34 ‰. Использование в качестве красителя метиленового синего позволило выявить варьирование уровня эритроцитов с микроядрами у самок от 0,74 до 1,74 ‰ (Cv = 12,79 %) при среднем значении 0,85 ± 0,05 ‰, у самцов – от 0,79 до 0,99 ‰ (Cv = 10,05 %) при среднем значении 0,88 ± 0,04 ‰. Число эритроцитов с микроядрами при подкраске светлым зеленым изменялось у самок от 0 до 0,77 ‰ (Cv = 92,36 %) при среднем значении 0,41 ± 0,17 ‰, у самцов – от 0,76 до 1,88 ‰ (Cv = 41,94 %) при среднем значении 1,08 ± 0,2 ‰.
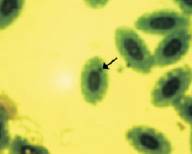
Азур-эозин по Романовскому–Гимза
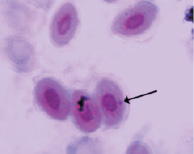
Орсеин
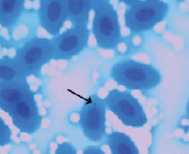
Метиленовый синий
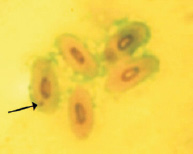
Светлый зеленый
Рис. 2. Эритроциты с микроядрами в периферической крови перепела японского при разных способах окраски. Объектив 40х, гомаль 1,5х, окуляр 10х
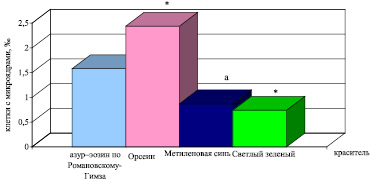
Рис. 3. Частота встречаемости эритроцитов с микроядрами в периферической крови перепела японского при разных способах окрашивания. Обозначения: * – различия с окраской азур-эозином по Романовскому–Гимза достоверны (P < 0,05), а – различия с окраской орсеином достоверны (P < 0,001)
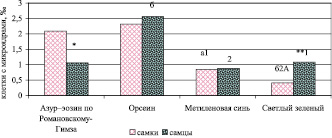
Рис. 4. Частота встречаемости эритроцитов с микроядрами в периферической крови самок и самцов перепела японского при разных способах окрашивания. Обозначения: * – различия с самками при данном способе окраски достоверны (P < 0,05), ** – различия с самками при данном способе окраски достоверны (P < 0,01); а – различия с окраской азур-эозином по Романовскому–Гимза достоверны (P < 0,05); б – различия с окраской азур-эозином по Романовскому–Гимза достоверны (P < 0,01); 1 – различия с окраской орсеином достоверны (P < 0,05); 2 – различия с окраской орсеином достоверны (P < 0,01); А – различия с окраской метиленовым синим достоверны (P < 0,05)
Исследование варьирования признака у представителей разных полов показало, что наибольшее изменение признака отмечается при окрашивании светлым зеленым как у самок, так и у самцов, наименьшее – при окрашивании метиленовым синим. Значение коэффициента вариации при окрашивании азур-эозином по Романовскому–Гимза и орсеином занимает промежуточное положение. В большинстве случаев варьирование признака больше у самок по сравнению с самцами. Наибольший размах изменчивости исследуемого показателя у самок мы можем объяснить гетерогаметностью данного пола.
Полученные данные по влиянию красителя на результаты микроядерного теста в эритроцитах периферической крови перепела мы можем объяснить биохимическими различиями их эритроцитов. Для перепелов японских в возрасте 3 месяцев установлены статистически значимые половые различия в количестве гемоглобина, уровне гематокрита, содержании лимфоцитов, количестве общего белка сыворотки крови, процентном содержании α-глобулинов в белковой фракции, количестве общих липидов [14].
Сравнение эффективности используемого красителя для выявления микроядер среди особей одного пола показало, что наименьшее число эритроцитов с микроядрами отмечается у самок при окраске метиленовым синим (0,85 ± 0,05 ‰ (различия с окраской азур-эозином по Романовскому–Гимза и орсеином достоверны (P < 0,05))) и светлым зеленым (0,41 ± 0,17 ‰ (различия с окраской другими красителями достоверны (P < 0,05)). Наибольшее число эритроцитов с микроядрами установлено у самцов при окраске орсеином (2,56 ± 0,34 ‰ (различия с окраской другими красителями достоверны (P < 0,05))).
Т.о., можно сделать следующие выводы. Оптимальным красителем при проведении микроядерного теста в эритроцитах периферической крови перепела японского является орсеин, т.к. выявляет наибольшее количество клеток с нарушениями и дает наименьший разброс индивидуальных значений при анализе разных особей, выявляет одинаковое количество нарушений у самок и самцов.
При окраске цитоплазматическим красителем (азур-эозин по Романовскому–Гимза) наибольшее число эритроцитов с микроядрами выявляется у самок, при ядерных красителях (орсеин, метиленовый синий, светлый зеленый) – у самцов. Показано, что разные способы окрашивания могут приводить к противоположным выводам о частоте встречаемости нарушений у особей разного пола (в зависимости от окрашивания различия между полами могут отсутствовать или большее число нарушений буде отмечаться у самок или самцов). Возможно предположить, что широко дискутируемый и до конца нерешенный вопрос о разной частоте клеточных нарушений у мужского и женского пола [3 и многие др.] связан с разными способами окрашивания материала. Использование стандартизированных методик позволит точно ответить на этот вопрос.
Рецензенты:
Ершова А.Н., д.б.н., профессор, зав. кафедрой биологии растений и животных естественно-географического факультета, ФГБОУ ВПО «Воронежский государственный педагогический университет», г. Воронеж;
Корнеева О.С., д.б.н., профессор, зав. кафедрой микробиологии и биохимии, ФГБОУ ВПО «Воронежский государственный университет инженерных технологий», г. Воронеж.
Работа поступила в редакцию 03.09.2013.



