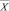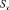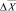Хлорамбуцил (4-[пара-[бис-(β-хлорэтил)-амино]фенил]масляная кислота) – это вещество из группы производных бис-(β-хлорэтил)-амина, широко применяющееся в медицинской практике в качестве противоопухолевого лекарственного средства. Является основным действующим веществом препаратов Лейкеран, Хлорбутин, Leukeran и др. По физическим свойствам – это белый кристаллический или зернистый порошок; практически нерастворим в воде (менее 0,01 г/100 мл), растворим в разбавленных растворах щелочей, этаноле, ацетоне, хлороформе и эфире [1, 2, 3].
Хлорамбуцил токсичен в отношении теплокровных животных и человека. LD50 для крыс при введении в желудок составляет от 40 мг/кг, при внутрибрюшинном введении – 21–23 мг/кг. Известны случаи отравления людей хлорамбуцилом, в том числе с летальным исходом [4, 5].
Широкое применение хлорамбуцила, его высокая токсичность и наличие случаев летальных отравлений обусловливают необходимость изучения данного вещества в химико-токсикологическом отношении.
До настоящего времени остаются недостаточно разработанными вопросы химико-токсикологического исследования хлорамбуцила, в частности, его определения в биологических жидкостях человека.
Целью исследования явилось изучение особенностей выделения хлорамбуцила из плазмы крови человека, его очистки методом жидкостной колоночной хроматографии низкого давления с последующим определением физико-химическими методами.
Материалы и методы исследования
Объектом исследования являлась субстанция хлорамбуцила фирмы «Sigma-Aldrich» с содержанием основного вещества не менее 99,5 %.
Готовили модельные смеси исследуемого вещества и плазмы крови человека, которые выдерживали при 18–20 °С в течение 1,5 часов после их приготовления. В качестве изолирующего агента использовался ацетон. На каждом этапе изолирования количество ацетона в два раза (по массе) превышало количество биологической жидкости.
Изолирование хлорамбуцила из плазмы крови. 25 г молельной смеси, состоящей из плазмы крови и определенного количества анализируемого вещества (2,5; 5,0; 12,5; 25,0 или 50,0 мг), заливали 50 г ацетона и выдерживали в течение 30 минут при периодическом перемешивании. Смесь фильтровали через бумажный фильтр, предварительно промытый ацетоном, а процесс настаивания повторяли в описанных выше условиях. Оба извлечения объединяли в выпарительной чашке и упаривали в токе воздуха при комнатной температуре до получения остатка, не содержащего растворитель.
Очистка на колонке с сорбентом «Силикагель КСК». Сухой остаток, полученный после испарения ацетона из объединенного извлечения, растворяли в 2 мл смеси растворителей гексан-диоксан-пропанол-2 (22,5:5:1), полученный раствор смешивали с 1,5 г сорбента «Силикагель КСК» 40/100 μ. После испарения растворителей сорбент с веществом вносили в стеклянную хроматографическую колонку размерами 120×11 мм, предварительно заполненную 8,5 г того же сорбента. Содержимое колонки уплотняли путем равномерного постукивания по внешней поверхности ее стенок. Хроматографировали, используя подвижную фазу гексан-диоксан-пропанол-2 (22,5:5:1). Элюат собирали фракциями по 2 мл. Фракции с 8-й по 22-ю включительно (15–44 мл), содержащие исследуемое вещество, объединяли и испаряли в токе воздуха при комнатной температуре. Сухой остаток растворяли в 10 мл ацетона. С полученным раствором проводили предварительную, подтверждающую идентификацию и количественное определение.
Предварительная идентификация методом ТСХ. 0,5 мл ацетонового раствора количественно переносили на линию старта хроматографической пластины «Сорбфил» марки ПТСХ-АФ-А-УФ. Хроматографировали в присутствии вещества-свидетеля в стеклянной камере объемом 600 см3, используя в качестве элюента систему растворителей гексан-диоксан-пропанол-2 в объемных соотношениях 12,5:5:1. Анализируемое вещество идентифицировали по величине Rf.
Подтверждающая идентификация методом электронной спектрофотометрии. После хроматографирования пятно анализируемого вещества вырезали из хроматограммы и помещали в пробирку. Хлорамбуцилэлюировали из сорбента этилацетатом двукратно порциями по 5 мл. Элюаты объединяли в выпарительной чашке и удаляли этилацетат в токе воздуха при комнатной температуре до получения сухого остатка. Хлорамбуцил, содержащийся в сухом остатке, переводили в соответствующее нитропроизводное путем обработки 10 % раствором нитрата калия в концентрированной серной кислоте в течение 5 минут. Исследовали особенности светопоглощения полученного раствора в интервале длин волн 200–400 нм, используя спектрофотометр СФ-56 и кварцевые кюветы с длиной оптического пути 10 мм. Измерения проводили на фоне контрольного раствора. Определяемое соединение идентифицировали по форме спектральной кривой и положению максимумов поглощения.
Количественное определение. Количество хлорамбуцила в извлечениях определяли по интенсивности поглощения его нитропроизводного в среде 10 % раствора гидроксида натрия в области длинноволнового максимума (λ = 325 нм), используя уравнение градуировочного графика.
Результаты исследования и их обсуждение
Установлено, что оптимальные условия изолирования хлорамбуцила из плазмы крови ацетоном достигаются при двукратном настаивании биологической жидкости с изолирующим агентом, если массовое соотношение изолирующего агента и биоматериала составляет не менее 2:1, а продолжительность каждого настаивания – не менее 30 минут.
При идентификации хлорамбуцила методом ТСХ, анализируемое вещество обнаруживается на хроматограммах в УФ-свете в виде темно-фиолетового пятна на более светлом общем фоне пластины. Его величина Rf соответствует величине Rf стандарта хлорамбуцила.
В процессе идентификации методом УФ-спектрофотометрии сравнивали спектральные кривые нитропроизводного хлорамбуцила, извлеченного из плазмы крови и очищенного по вышеописанной схеме, со спектром нитропроизводного чистой субстанции. Обнаруживалось совпадение формы спектральной кривой и положения точек экстремумов (260 и 325 нм).
Уравнение градуировочного графика для фотометрического определения хлорамбуцила по поглощению его нитропроизводного в ультрафиолетовой области спектра имело вид:
А = 0,01562·С – 0,004535,
где А – оптическая плотность; С – концентрация анализируемого вещества в фотометрируемом растворе (мкг/мл).
Результаты количественного определения хлорамбуцила в плазме крови человека представлены в таблице.
Полученные данные показывают, что увеличение содержания хлорамбуцила в модельных смесях в достаточно большом интервале концентраций (2,5–50,0 мг) при постоянной массе плазмы (25 г) сопровождалось незначительным изменением среднего значения степени извлечения, не превышающим 2,0 %. Это позволяет предположить, что изолирующий агент позволяет разрушить лабильные связи хлорамбуцила с эндогенными веществами биологической матрицы. Относительная ошибка среднего результата при этом не превышала 4,81 % (n = 5; Р = 0,95).
Результаты определения хлорамбуцила в плазме крови человека (n = 5; P = 0,95)
|
Внесено хлорамбуцила, мг в 25 г плазмы |
Найдено, % |
||||
|
|
S |
|
|
ε |
|
|
2,5 |
84,33 |
3,53 |
1,58 |
4,06 |
4,81 |
|
5,0 |
84,88 |
3,03 |
1,35 |
3,48 |
4,10 |
|
12,5 |
85,43 |
2,76 |
1,23 |
3,17 |
3,71 |
|
25,0 |
85,93 |
2,41 |
1,08 |
2,77 |
3,22 |
|
50,0 |
86,25 |
1,97 |
0,88 |
2,26 |
2,62 |
Предлагаемая методика позволяет определить до 86,25 % хлорамбуцила в плазме крови с достаточной для биологических исследований воспроизводимостью и правильностью. При уменьшении содержания анализируемого вещества в модельных смесях с 50,0 до 2,5 мг полуширина доверительного интервала возрастает с 2,26 до 4,06 (n = 5; р = 0,95).
Выводы
1. Для изолирования хлорамбуцила из плазмы крови человека предложен ацетон.
2. Определены оптимальные условия очистки хлорамбуцила, выделенного из плазмы крови, методом жидкостной колоночной хроматографии низкого давления.
3. На основе проведенных исследований разработана методика идентификации и количественного определения хлорамбуцила в плазме крови.
Рецензенты:
Масляков В.В., д.м.н., профессор, проректор по научной работе и связям с общественностью, заведующий кафедрой клинической медицины, НОУ ВПО «Саратовский медицинский институт «РЕАВИЗ», г. Саратов;
Громов М.С., д.м.н., профессор, генеральный директор, ООО «Частная клиника № 1», г. Саратов.
Работа поступила в редакцию 30.10.2013.