В настоящее время в связи с ростом заболеваемости подагрой (1–3 %) и высоким риском кардиоваскулярных осложнений подагра рассматривается как важная медико-социальная проблема [1, 4]. Сочетание АГ с обменными нарушениями имеет огромную значимость. Результаты ряда исследований свидетельствуют о том, что ГУ является предиктором развития сердечно-сосудистых событий и смерти у больных с АГ и застойной сердечной недостаточностью, и, по-видимому, может рассматриваться как независимый фактор риска сердечно-сосудистых осложнений [3, 4, 6]. По данным ряда авторов, частота АГ у больных подагрой колеблется от 36 до 58 %, а в сочетании с метаболическим синдромом увеличивается до 72 % [7, 8, 9, 10, 10, 12].
Цель исследования ‒ оценить взаимосвязь ГУ с особенностями суточного профиля АД у больных подагрой и бессимптомной гиперурикемией (БГУ) в сочетании с АГ.
Материалы и методы исследования
В исследование были включены больные в возрасте от 41 до 70 лет (средний возраст 57,6 ± 6,34 лет), из них 31 мужчина (52 %) и 29 женщин (48 %). Всем пациентам проводилось общеклиническое обследование с оценкой антропометрических показателей: рост, вес, ИМТ, окружность талии (ОТ), окружность бедра (ОБ), отношение ОТ/ОБ. Определение степени ожирения оценивалось согласно критериям ВОЗ (1997). Выполнялось биохимическое исследование крови с определением общего холестерина (ХС), ХС ЛПВП, ХС ЛПНП, триглицеридов (ТГ), индекса атерогенности (ИА), мочевины, креатинина, мочевой кислоты (МК) крови, РФ, СРБ. Оценивались общие анализы крови и мочи с суточной экскрецией МК в моче, сахар крови натощак. Инструментальное обследование включало: электрокардиография (ЭКГ), эхокардиография (ЭХО КГ), суточное мониторирование АД (СМАД), УЗИ почек. За норму показателей принимались уровни ОХ и ТГ – 5,0 и 1,7 ммоль/л соответственно.
Все пациенты были разделены на две группы: I группу (n = 30) составили пациенты с подагрой, II группу (n = 30) ‒ с БГУ в сочетании с АГ I–III степени. Согласно критериям Европейской антиревматической лиги, за норму принято считать уровень МК в крови < 360 ммоль/л [14]. Диагноз подагры выставляли в соответствии с критериями S.L. Wallace [13]. Учет числа атак проводился анамнестически и по данным медицинской карты. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза оценивалась в соответствии с Рекомендациями экспертов Всероссийского научного общества кардиологов (ВНОК 2004). Критерии исключения из исследования: тяжелая тофусная подагра, вторичные артериальные гипертензии, сердечно-сосудистые события в анамнезе, аритмии, сахарный диабет, тяжелые сопутствующие заболевания желудочно-кишечного тракта, печени, почек, тяжелая сердечная недостаточность, онкологический анамнез.
Полученные результаты статистически обрабатывались с использованием методов описательной статистики с вычислением средней арифметической (М) и стандартного отклонения (SD). Сравнение клинических данных проводилось с помощью (х²), корреляционного анализа по методу Спирмена. Применялись непараметрический методы – критерий Вилкоксона и Манна‒Уитни. Уровень статистически достоверной значимости принимался при р < 0,05.
Результаты исследования и их обсуждение
Клиническая характеристика больных, включенных в исследование, представлена в табл. 1.
Таблица 1
Клиническая характеристика пациентов
|
Показатели |
I группа (n = 30) |
II группа (n = 30) |
|
Пол, м/ж |
26/4 (87 %-13 %)** |
5/25 (17 %-83 %) |
|
Возраст, годы (М ± SD) |
53,51 ± 12,37 |
56,28 ± 6,39 |
|
Степени АГ |
||
|
I ст. |
11 (37 %) |
9 (30 %) |
|
II ст. |
16 (53 %) |
17 (57 %) |
|
III ст. |
3 (10 %) |
4 (13 %) |
|
Длительность АГ, годы |
9,62 ± 4,31 |
12,82 ± 4,76 |
|
Длительность подагры, годы |
5,29 ± 2,37 |
– |
|
Количество приступов артрита в год |
2,75 ± 1,37 |
– |
|
Количество больных с остеоартрозом (n, %) |
16 (53 %) |
28 (93 %) * |
|
ИМТ, кг /м² |
29,73 ± 2,85 |
35,43 ± 5,93 * |
|
Избыточная масса тела |
15 (50 %) |
9 (30 %) |
|
Ожирение I ст. |
10 (33 %) |
10 (33 %) |
|
Ожирение II ст. |
5 (17 %) |
8 (27 %) |
|
Ожирение III ст. |
– |
3 (10 %)* |
|
ОТ, см |
96,72 ± 7,29 |
103,26 ± 9,52 |
|
ОБ, см |
57,51 ± 6,52 |
59,18 ± 5,69 |
|
ОТ/ОБ |
1,62 ± 0,25 |
1,8 ± 0,21 |
|
ИММ ЛЖ, г/м² |
131,2 ± 4,25 |
122,1 ± 5,73 |
|
Нефролитиаз n, % |
23 (77 %)** |
13 (43 %) |
|
Ангиопатия сетчатки |
17 (57 %) |
22 (73 %) |
Примечание. Данные представлены в (М ± SD); * – р < 0,05; ** – p < 0,01 *** – р < 0,001 (по критерию Манна‒Уитни).
Из табл. 1 следует, что обе группы достоверно различались по половому составу. Среди больных подагрой преобладали мужчины (87 %), а при БГУ ‒ женщины (83 %). Средняя продолжительность заболевания подагрой составила 5,29 ± 2,37 лет, с частотой обострения артрита в среднем 3 (от 1 до 4) атаки в год. Преобладало рецидивирующее течение заболевания у 18 человек (60 %), хроническое течение было у 12 человек (40 %). Количество пораженных суставов составило 4 (от 3 до 6), 20 % пациентов имели внутрикожные и подкожные тофусы. На момент исследования больные находились в межприступном периоде (более двух недель после купирования артрита) и ранее не принимали антигиперурикемические препараты. У больных II группы в 93 % выявлялся остеоартроз.
Анализ антропометрических данных показал, что половина больных подагрой и 30 % с БГУ имели избыточную массу тела, по 33 % – I ст., 17 и 27 % – II ст. и только при БГУ 10 % больных – III ст. абдоминального ожирения. Отношение ОТ/ОБ составило 1,62 ± 025, и 1,8 ± 0,21 у пациентов I и II групп, что статистически значимо выше нормальных показателей (р < 0,01).
Изменения липидного профиля обнаружены у подавляющего большинства больных обеих групп, причем у больных подагрой показатели были достоверно хуже. Почти у половины пациентов отмечалось повышение уровня ХС общего (средн. 6,27 ± 1,3 и 6,01 ± 0,86 ммоль/л), ХС ЛПНП (средн. 3,65 ± 1,09 и 3,61 ± 0,58 ммоль/л), ТГ (средн. 1,69 ± 1,42 и 1,56 ± 0,6 ммоль/л), ИА (средн. 4,39 ± 1,68 и 3,74 ± 1,32 Ед) у больных I и II групп соответственно. Только у 7 % больных I группы и 10 % больных II группы показатели липидного обмена были в пределах нормы. Длительность подагры у пациентов с нормальными показателями липидного профиля была значительно меньше (3,4 ± 2,1 года). Коэффициент ИА оказался повышенным у 24 (80 %) и 20 (67 %) больных I и II групп соответственно. У больных I группы достоверно был выше уровень МК крови 503,28 ± 68,08 ммоль/л против 432,5 ± 62,03 ммоль/л (p < 0,01) и уровень креатинина 102,67 ± 29,96 ммоль/л против 89,26 ± 14,6 ммоль/л при БГУ. Результаты корреляционной зависимости по Спирмену уровня МК в крови с клинико-лабораторными показателями, отражающими взаимосвязь обменных нарушений при подагре и БГУ, показали прямую корреляционную связь между величиной ГУ и показателями, отражающими степень ожирения (ИМТ r-0,32, ОТ/ОБ r-0,29), (p < 0,01). Кроме того, концентрация МК в крови статистически значимо прямо коррелировала с показателями атерогенного профиля (ХС общим r-0,32, ЛПНП r-0,37 при (p < 0,01), а также с уровнем триглицеридемии r-0,35 (p < 0,05). Отмечалась низкая корреляционная связь между уровнем МК с ЛПВП и показателями ср. САД и ДАД 24, ИММ ЛЖ.
Продолжительность АГ составила 9,62 ± 4,31 и 12,82 ± 4,76 лет у больных I и II группы соответственно. У пациентов обеих групп преобладала АГ II степени – 53–57 %, реже встречалась I ст. – 37–30 % и III ст. – 10 и 13 %, в I и II группах соответственно. Показатели средне-дневных и ночных значений САД и ДАД, индекса времени (ИВ) САД и ДАД статистически значимо отличались от нормальных в обеих группах (табл. 2).
Таблица 2
Средний уровень САД и ДАД по данным cуточного мониторирования АД
|
Показатель |
I группа |
II группа |
Контроль |
|
САД днем, мм рт.ст. |
161,26 ± 22,85* |
157,67 ± 28,9 * |
< 140 |
|
САД ночью, мм рт.ст. |
141,69 ± 24,81* |
141,4 ± 29,21* |
< 120 |
|
ИВ САД % |
59,65 ± 30,19** |
53,12 ± 37,78** |
< 20 % |
|
Вариабельность САД, мм рт. ст. |
17,76 ± 5,37 |
16,36 ± 3,42 |
< 15 |
|
ДАД днем, мм рт.ст. |
90,96 ± 14,87 |
94,53 ± 15,66 |
< 90 |
|
ДАД ночью, мм рт.ст. |
92,35 ± 16,36 * |
89,87 ± 16,48 |
< 70 |
|
ИВ ДАД % |
70,27 ± 29,11** |
68,6 ± 33,49** |
< 15 |
|
Вариабельность ДАД, мм рт. ст. |
11,65 ± 3,59 |
9,72 ± 3,13 |
< 13 |
Примечание. Данные представлены в (М ± SD); * – р < 0,05; ** – p < 0,01 (по критерию Манна‒Уитни).
Повышенные цифры ср. САД и ДАД в дневные и ночные часы, индекса времени САД, величины утреннего подъема САД чаще выявлялись у больных подагрой по сравнению с БГУ (табл. 3).
Таблица 3
Количество больных с повышенным уровнем АД (абс., %)
|
Показатель |
I группа |
II группа |
χ ² |
|
САД днем, мм рт.ст. |
22 (73,3 %) ** |
18 (60 %) |
< 0,05 |
|
САД ночью, мм рт.ст. |
24 (80 %) |
22 (73,3 %) |
> 0,05 |
|
ИВ САД, % |
26 (86,7 %) ** |
20 (66,7 %) |
< 0,05 |
|
Вариабельность САД, мм рт. ст. |
28 (93,3 %) |
26 (86,7 %) |
> 0,05 |
|
ДАД днем, мм рт.ст. |
14 (46,7 %) |
14 (46,7 %) |
> 0,05 |
|
ДАД ночью, мм рт.ст. |
24 (80 %) |
22 (73,3 %) |
> 0,05 |
|
ИВ ДАД, % |
29 (96,7 %) |
28 (93,3 %) |
> 0,05 |
|
Вариабельность ДАД, мм рт. ст. |
15 (50 %) |
14 (46,7 %) |
> 0,05 |
|
ВУП САД, мм рт. ст. |
10 (33,3 %) * |
6 (20 %) |
< 0,01 |
|
ВУП ДАД, мм рт. ст. |
17 (56,7 %) ** |
6 (20 %) |
< 0,01 |
Примечание. * – р < 0,05; ** – p < 0,01 (по критерию χ²).
Гипертрофия левого желудочка (ГЛЖ) диагностировалась при индексе массы миокарда левого желудочка (ИММ ЛЖ) > 130 г/м² у мужчин и > 110 г/м² у женщин (по данным ЭХО КГ). У больных I группы ГЛЖ была выявлена у 32 %, II группы – у 37 %.
На рисунке представлено нарушение суточного профиля САД в обеих группах больных. Количество пациентов с нормальным суточным профилем САД (диппер) в I и II группах составило соответственно 38 и 42 %. Прогностически неблагоприятные нарушения суточного профиля АД (нон-диппер и найт-пикер) выявлялись чаще у больных I группы 42 и 20 % по сравнению с II группой 36 и 17 % соответственно (p < 0,05). Нарушения суточного профиля ДАД имели аналогичные характеристики. Таким образом, отмечалось более тяжелое течение АГ и преобладание неблагоприятных типов суточного ритма АД у больных подагрой.
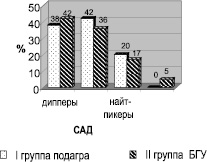
Нарушения суточного профиля САД у больных подагрой и ГУ
Полученные в ходе исследования результаты показали существование взаимосвязей ГУ с ожирением, нарушением обмена липопротеидов (увеличением уровня ОХ, ЛПНП, гипертриглицеридемией), а также АГ и поражением органов-мишеней. У больных подагрой и БГУ прогностическое значение АГ становится особенно неблагоприятным в связи с высокой частотой сопутствующих обменных нарушений. В нашем исследовании нарушение обмена липопротеидов выявлено у 93 % больных подагрой и 90 % при БГУ, а сочетание гипертриглицеридемии и ГУ у лиц с абдоминальным ожирением при подагре у 45 %, при БГУ у 22 % пациентов. Взаимосвязь уратного дисметаболизма и ожирения, прежде всего абдоминального, подтверждается рядом популяционных исследований, указывающих на значительную частоту БГУ у лиц с избыточным весом и ожирением [7]. Известно, что у подобных больных вероятность поражения органов-мишеней особенно высока (ГЛЖ, гиперкреатининемия, микроальбуминемия, увеличение толщины интима-медиа сонных артерий) [3].
Анализ данных нашего исследования указывает на сочетание гиперурикемии с более выраженным повышением АД. У больных подагрой и БГУ преобладала II ст. (53 и 57 %) и I ст. АГ (37 и 30 %) с преобладанием неблагоприятных характеристик суточного профиля АД по типу недостаточного снижения АД в ночное время и ночная гипертония («нон-дипперы» и «найт-пикеры»). В ряде работ показано, что у больных с ГУ изменения суточного профиля АД характеризовались тенденцией к уменьшению степени ночного снижения ДАД и инверсией суточного ритма ДАД, а также повышением ночной вариабельности АД [2, 5, 11].
В связи с вышесказанным коррекцию нарушений обмена МК на фоне АГ следует рассматривать в ряду первоочередных мер первичной и вторичной профилактики, включающих, прежде всего, воздействие на особенности образа жизни – ограничение пищевых продуктов, содержащих большое количество пуриновых оснований, отказ от приема алкоголя и назначение адекватной антигиперурикемической и антигипертензивной терапии у больных подагрой, так и с бессимптомной гиперурикемией.
Выводы
1. У больных подагрой и бессимптомной гиперурикемией в сочетании с артериальной гипертензией выявлены прямые корреляционные взаимосвязи с ожирением, нарушением обмена липидов, поражением органов-мишеней.
2. Гиперурикемия у данных категорий больных сочеталась с более выраженным повышением АД и преобладанием неблагоприятных изменений суточного профиля АД по типу нон-диппер и найт-пикер.
3. У больных подагрой изменения суточного профиля АД характеризовались статистически значимо более выраженным уменьшением степени ночного снижения и инверсией суточного ритма САД и ДАД.
Рецензенты:
Козлова Л.К., д.м.н., профессор кафедры факультетской терапии, ГБОУ ВПО «Оренбургская государственная медицинская академия» Министерства здравоохранения РФ, г. Оренбург;
Шилова Л.Н., д.м.н., заведующая кафедрой госпитальной терапии, военно-полевой терапии с курсом ревматологии, ФУВ ГБОУ ВПО «Волгоградский государственный медицинский университет» Министерства здравоохранения РФ, г. Волгоград.
Работа поступила в редакцию 30.11.2013.



