В настоящее время протеолитические ферменты широко используются в медицине в качестве лекарственных средств [1, 10]. Наиболее предпочтительными являются комплексные препараты протеиназ в сравнении с моноферментными препаратами [1]. Важнейшими свойствами протеиназ являются некролитическое, противовоспалительное, антитоксичное действия [10].
Протеолитический комплекс (ПК) из гепатопанкреаса камчатского краба представляет собой полиферментный препарат, состоящий как минимум из 9 различных сериновых протеиназ, содержащий в том числе истинные коллагеназу и эластазу. Физико-химические и биологические свойства ПК изучены довольно широко. Существенным признаком ферментов ПК является их необычайно низкая изоэлектрическая точка: значение pI ниже 3.5 [1, 6, 9].
Однако широкое применение протеолитических ферментов в практической медицине затруднено из-за их нестабильности, способности подвергаться автолизу, быстрой инактивации тканевыми ингибиторами и т.д. Вместе с тем многие ферментные препараты дороги и дефицитны, что значительно ограничивает их применение. Преодолеть эти недостатки удалось путем создания иммобилизованных ферментов [1].
Ферменты, иммобилизованные на волокнообразующих носителях, имеют ряд преимуществ: более устойчивы к внешним воздействиям, сохраняют активность в более жестких условиях, не подвергаются автолизу и значительно менее чувствительны к действию тканевых белковых ингибиторов [1, 14]. В связи с этим использование иммобилизованных протеолитических ферментов позволило значительно продлить их действие в патологическом очаге, уменьшить частоту введения и количество расходуемого фермента. При их применении отмечается более высокий терапевтический эффект, значительно сокращаются сроки очищения и заживления ран, уменьшается расход препаратов по сравнению с использованием свободных ферментов [1, 14]. Хитозан обладает свойствами, благоприятными для введения его в иммобилизованную систему «перевязочный материал – ПК», а именно биосовместимостью, биодеструкцией, нетоксичностью, гидрофильностью, высокой адгезионной способностью и т.д. [14].
Стабильность ферментов остается одной из самых важных проблем в современной химии биополимеров. Сохранение ферментативной активности при температурной инактивации фермента является важным параметром, который необходим для дальнейшего его практического применения [1, 4, 11].
Цель данной работы – проведение исследований стабильности иммобилизованных (стабилизированных), полученных при различных условиях форм ПК в диапазоне температур 25–55 °С.
Материалы и методы исследования
В работе использовали протеолитический комплекс из гепатопанкреаса краба (ТУ 9281-004-11734126-00, НПО «Биопрогресс» МО г. Щелково, Россия), хитозан производства НПО «Биопрогресс» (г. Щелково, МО, РФ) (влажность препарата 10 %, ТУ 9289-067-00472124-03, степень деацилирования 80.0 %; кинематическая вязкость не менее 383.7 сСт; молекулярная масса 478 Да). Все остальные реактивы отечественного производства, квалификации не ниже «ХЧ».
Активацию целлюлозного (Ц) носителя в виде тканых полотен (медицинской марли), проводили перйодатом натрия, в результате чего получали диальдегидцеллюлозу (ДАЦ) требуемой степени модификации вторичных спиртовых групп [8]. Количество альдегидных групп на целлюлозном носителе определяли окислением йодом в слабощелочных условиях и выражали в мгЭкв/г с учетом влажности носителя [15]. После химической модификации носителя следует стадия иммобилизация ПК на модифицированном текстильном носителе аналогично [1, 14]. Содержание Хт на носителе составляло 8 мг/г носителя, содержание ПК составило 7 мг/г носителя. Ферментативные активности препаратов определяли с использованием в качестве субстрата либо азоколла [1, 2, 5], либо раствора казеина [1, 2], BApNA аналогично [1, 12, 13].
Модификацию ПК раствором Хт проводили путем сливания равных объемов ПК (раствор 2 мг/мл в 0,1 М NaCl) и уксуснокислый раствор Хт (0,5 масс %). Полученный гель содержал 1 мг ПК и 2,5 мг Хт в 1 мл геля.
Пленки, содержавшие ПК, получали путем высушивания 100 мкл 1 мг/мл ПК на полиэтиленовом носителе. Пленки, содержащие Хт-ПК, получали с помощью высушивания 100 мкл геля Хт-ПК или нанесения на высохшую пленку Хт раствора ПК.
Термостабильность препаратов ПК исследовали в 1/15 М фосфатном буферном растворе при рН 6.2. Концентрация ферментного комплекса была приблизительно одинакова во всех растворах и равнялась 1 мг/мл. Пробирки с пробами помещали в предварительно прогретый водный термостат (25–55 °С). В определенное время пробирки отбирали и измеряли остаточную активность фермента [1].
Константу скорости инактивации kин определяли как тангенс угла наклона прямой зависимости натурального логарифма величины остаточной активности от времени (полулогарифмические координаты ln(A/A0) – τ) аналогично [4, 11].
Результаты исследования и их обсуждение
Термоинактивация различных форм ПК была исследована в диапазоне температур 25–55°С и различных средах. На рис. 1 приведен график зависимости величин остаточной ферментативной активности от времени при 37 °С в фосфатном буфере рН 6,2. Аналогичные зависимости были получены в процессе термоинактивации ПК в других условиях.
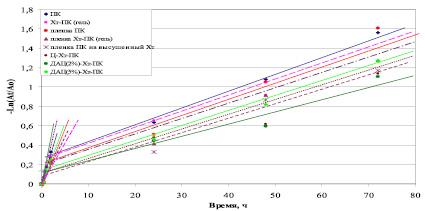
Рис. 1. Зависимость остаточной активности различных форм ПК в 1/15 М фосфатном буферном растворе рН 6,2 от времени при 37 °С. ДАЦ(2 %) – содержание альдегидных групп мМ/г, ДАЦ(5 %) – мМ/г (где Аt/А0 – отношение активности формы ПК в определенный момент времени к активности немодифицированного ПК в начальный момент времени)
Кинетика инактивации ПК описывается простой Аτ/А0 = ае–кτ или сложной экспоненциальной Аτ/А0 = а1е–к1τ + а2е–к2τ зависимостью. Кинетические закономерности такого рода могут быть объяснены общим механизмом инактивации, включающим существование двух форм фермента, различающихся активностью и устойчивостью к денатурирующим воздействиям. То есть вне зависимости от конкретных деталей механизма и соотношения элементарных констант, двухэкспоненциальный характер инактивации показывает, что механизм инактивации включает, по крайней мере, две различающиеся по активности или устойчивости формы фермента [1,4].
Как было ранее доказано, каждая из полученных ломаных линий описывается уравнениями первого порядка. При изучении термоинактивации ПК (в исследованном диапазоне концентраций 0,1–10 мг/мл) автолиз или агрегация обнаружены не были [1, 4].
В табл. 1 приведены значения констант скорости инактивации раствора ПК, геля хитозан (Хт)-ПК, пленок ПК и Хт-ПК и иммобилизованных препаратов на хитозансодержащих целлюлозных носителях в фосфатном буфере рН 6,2.
Таблица 1
Эффективные константы скорости термоинактивации различных форм ПК в зависимости от условий инактивации
|
Условия инактивации |
25 °С |
37 °С |
45 °С |
55 °С |
|
ПК |
||||
|
ФБрН 6,2 азоколл |
k = 0,0082 ч–1 |
k = 0,0223 ч–1 |
k1 = 0,8632 ч–1 k2 = 0,0732 ч–1 |
k = 4,8385 ч–1 |
|
ФБрН 6,2 BApNA |
k = 0 |
k1 = 2,23 ч–1 k2 = 0,029 ч–1 |
k1 = 6,62 ч1 k2 = 0,80 ч–1 |
- |
|
ФБрН 6,2 казеин |
k = 0 |
k1 = 0,18 ч–1 k2 = 0,020 ч–1 |
k1 = 0,58 ч–1 k2 = 0,024 ч–1 |
- |
|
Хт-ПК (гель) |
||||
|
ФБрН 6,2 азоколл |
k = 0,0048ч–1 |
k1 = 0,1082 ч–1 k2 = 0,0091 ч–1 |
k1 = 0,5074 ч–1 k2 = 0,0606 ч–1 |
k = 2,6156 ч–1 |
|
Ц-Хт-ПК |
||||
|
ФБрН 6,2 азоколл |
k = 0,004 ч–1 |
k1 = 0,1367 ч–1 k2 = 0,0077 ч–1 |
k = 0,6255 ч–1 k2 = 0,0431 ч–1 |
- |
|
ФБрН 6,2 BApNA |
k = 0,9078 ч–1 |
k1 = 0,8797 ч–1 k2 = 0,0438 ч–1 |
k = 1,3554 ч–1 |
- |
|
ДАЦ(2)-Хт-ПК |
||||
|
ФБрН 6,2 азоколл |
k = 0,004 ч–1 |
k1 = 0,0194ч–1 k2 = 0,0126 ч–1 |
k1 = 0,4294 ч–1 k2 = 0,0521ч–1 |
- |
|
ФБрН 6,2 BApNA |
k = 0 |
k1 = 1,72 ч–1 k2 = 0,03 ч–1 |
- |
- |
|
ФБрН 6,2 казеин |
k = 0 |
k1 = 0,33 ч–1 k2 = 0,04 ч–1 |
k1 = 2,2 ч–1 k2 = 0,6 ч–1 |
- |
|
ДАЦ(5)-Хт-ПК |
||||
|
ФБрН 6,2 азоколл |
k = 0,0098 ч–1 |
k1 = 0,1209 ч–1 k2 = 0,0169 ч–1 |
k1 = 0,4283 ч–1 k2 = 0,0293ч–1 |
- |
|
Пленка ПК |
||||
|
ФБрН 6,2 азоколл |
k = 0,0092 ч–1 |
k1 = 0,1102 ч–1 k2 = 0,0109 ч–1 |
k1 = 0,3273 ч–1 k2 = 0,0173ч–1 |
- |
|
Пленка Хт-ПК (гель) |
||||
|
ФБрН 6,2 азоколл |
k = 0,0092 ч–1 |
k1 = 0,0902 ч–1 k2 = 0,0083 ч–1 |
k1 = 0,2973 ч–1 k2 = 0,0179ч–1 |
- |
|
Пленка ПК на высушенном Хт |
||||
|
ФБрН 6,2 азоколл |
k = 0,0092 ч–1 |
k1 = 0,0882 ч–1 k2 = 0,0079 ч–1 |
k1 = 0,2763 ч–1 k2 = 0,0163ч–1 |
- |
Определение активационных параметров процесса термоинактивации ПК
На основе полученных данных (табл. 1) были рассчитаны термодинамические параметры процесса термоинактивации. Для анализа процесса инактивации ПК во всем диапазоне температур можно применить теорию активированного комплекса [4, 11].
Основным уравнением теории активированного комплекса является уравнение (1), все расчеты были проведены аналогично [4, 11], описывающее зависимость константы скорости первого порядка от температуры:
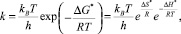 (1) [11]
(1) [11]
где kB и h – константы Больцмана и Планка соответственно; ΔG*, ΔH* и ΔS* – изменения энергии, энтальпии и энтропии; R – универсальная газовая постоянная; Т – температура в градусах Кельвина.
Линейный вид уравнения (1):
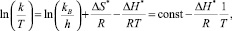
где 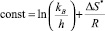 . [11]
. [11]
На рис. 2 представлены зависимости констант скоростей инактивации от температуры в координатах ln(kин/T) – 1/T. По данному графику видно, что зависимости имеют линейный вид, что свидетельствует о том, что они описываются уравнением теории активированного комплекса. Величина ΔH* может быть получена из тангенса угла наклона прямых на рис. 2.
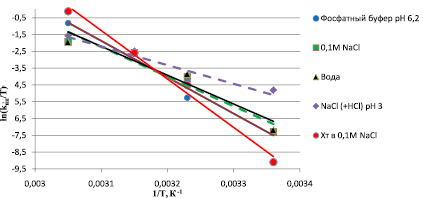
Рис. 2. Зависимость константы скорости инактивации ПК от температуры в координатах ln(kин/T) – 1/T в различных средах (где kин – константа скорости инактивации ПК; Т – температура, °К)
Согласно уравнению (2) из тангенса угла наклона зависимости ΔG* от Т были рассчитаны значения ΔS*.
ΔG* = ΔH* – TΔS*. (2)[11]
Расчет значений ΔG* производился с помощью следующего выражения:
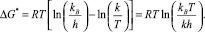
В табл. 2 представлены значения ΔH* и ΔS* для растворов ПК в различных условиях. Процесс термоинактивации сопровождается увеличением значений ΔH* и ΔS* [11].
Как видно из полученных данных табл. 1, 2, Хт стабилизирует ПК от тепловой инактивации, иммобилизация ПК на хитозанпроизводных целлюлозы стабилизирует в меньшей степени.
Наибольшая стабильность ПК выявлена в геле хитозана рН 3,0 (наименьшие значения kин при различных температурах, значение ΔH* = 28844 Дж/моль, что меньше в ~2 раза соответствующих ΔH* для других форм ПК). С изменением реакционной среды происходит увеличение kин в 2–17 раз в зависимости от температуры (табл. 1). При изменении условий термоинактивации меняется ход температурных зависимостей величины kин. Наиболее быстро она меняется при использовании среды с хитозаном, а наиболее медленно – в среде 0,1 М NaCl (+ HCl) рН 3,0. Это может быть связано с изменением заряда функциональных групп белкового комплекса (например, взаимодействие отрицательного заряда карбоксильных групп ПК с положительно заряженными аминогруппами хитозана).
Таблица 2
Значения активационных параметров процесса термоинактивации ПК в различных средах (где ΔH* – изменение энтальпии, Дж/моль; ΔS* – изменение энтропии, Дж/К·моль)
|
Условия инактивации |
ΔH*, Дж/моль |
ΔS*, Дж/К*моль |
|
Н2О |
–17160 |
–110,54 |
|
Фосфатный буфер рН 6,2 |
–22260 |
–256,59 |
|
0,1 М NaCl (+ HCl) pH 3,0 |
–11127 |
–36,21 |
|
0,1 M NaCl |
–17660 |
–123,81 |
|
Хт в 0,1 M NaClpH 3,0 |
–28844 |
–275,76 |
|
Ц-Хт-ПК |
–10851 |
–118,74 |
|
ДАЦ(2 %)-Хт-ПК |
–11587 |
–217,45 |
|
ДАЦ(5 %)-Хт-ПК |
–4807 |
–35,45 |
Количественной мерой стабилизации при тепловой инактивации служит величина эффекта стабилизации (Θt) при данной температуре (табл. 3), которая представляет собой отношение констант скорости инактивации нативного и модифицированного фермента [4,7]. Если Θt > 1, значит, иммобилизация ферментов стабилизирует их при данной температуре. Для иммобилизованных препаратов согласно [7] расчет Θ необходимо проводить, используя k2.
Таблица 3
Влияние условий инактивации на эффекты стабилизации (Θt) в присутствии различных добавок в 1/15М ФБ рН-6,2, субстрат азоколл
|
Условия инактивации |
25 °С |
37 °С |
45 °С |
|
Хт-ПК (гель) |
Θ = 1,71 |
Θ = 2,45 |
Θ = 1,21 |
|
Пленка Хт-ПК (гель) |
Θ = 0,89 |
Θ = 2,68 |
Θ = 4,09 |
|
Пленка ПК на высушенном Хт |
Θ = 0,89 |
Θ = 2,82 |
Θ = 4,49 |
|
Ц-Хт-ПК |
Θ = 2,05 |
Θ = 2,90 |
Θ = 1,70 |
|
ДАЦ(2)-Хт-ПК |
Θ = 2,05 |
Θ = 1,77 |
Θ = 1,40 |
|
ДАЦ(5)-Хт-ПК |
Θ = 0,83 |
Θ = 1,32 |
Θ = 2,50 |
Инактивация ПК, иммобилизованного на хитозанпроизводных целлюлозы, может быть вызвана неблагоприятным влиянием альдегидов, вступающих в реакцию с аминогруппами белка, тем самым меняя его структуру. Как нами было установлено в специально проведенных опытах, водорастворимые альдегиды инактивируют ПК (титрование формальдегидом ПК). В условиях гидролитической деструкции композита (производных целлюлозы) на основе ДАЦ в первую очередь в раствор переходят фрагменты, содержащие альдегидные группы [1,8].
Заключение
В данной работе были проведены исследования стабильности иммобилизованных форм ПК, полученных в различных условиях, в диапазоне температур 25–55 °С. Было показано, что хитозан оказывает стабилизирующий эффект на протеолитический комплекс при тепловой инактивации. Наиболее благоприятными условиями для сохранения ферментативной активности ПК явились Хт в 0,1 M NaClpH 3,0 и фосфатный буфер рН 6,2. Наиболее устойчивым к тепловой инактивации препаратом является иммобилизованный препарат ДАЦ(2)-Хт-ПК.
Рецензенты:
Красноштанова А.А., д.х.н., профессор кафедры биотехнологии РХТУ им. Д.И. Менделеева, г. Москва;
Медушева Е.О., д.м.н., зам. генерального директора по научной работе НИИТМ текстильных материалов, г. Москва.
Работа поступила в редакцию 19.12.2013.



