Фундаментальные основы радикального хирургического лечения рака мочевого пузыря (РМП) изложены в работах М.И. Когана, В.А. Перепечай (2002), А.С. Переверзева, С.Б. Петрова (2002), И.В. Чернышева (2004), В.Р. Латыпова (2005), С.А. Красного (2010), Б.П. Матвеева (2011), E.W. Gerharz et al., 2004; J.P. Stein, D.G. Skinner (2005), R.E. Hautmann (2005), A. Stenzl (2005), U.E. Studer (1997) и мн. др. Несоответствие в показателях периоперационной смертности (от 2,0 до 26,9 %) при выполнении радикальной цистэктомии (РЦЭ) у больных мышечно-инвазивным РМП, в частоте развития осложнений раннего (от 11 до 70 %) и позднего (от 12 до 23,4 %) послеоперационного периода, количестве повторных операций (от 8,7 до 30 %) не может удовлетворять онкоурологов [1, 2, 4, 5, 6].
Разноречивые результаты радикального хирургического лечения РМП высвечивают пробелы и отсутствие единой позиции различных школ в отношении необходимого и достаточного объёма оперативного вмешательства. В то же время при оценке результатов лечения РМП следует быть прагматичным и различать, с одной стороны, результаты так называемых «авторских серий» и данные отдельных высокоспециализированных центров и, с другой стороны, результаты многоцентровых рандомизированных исследований, метаанализов и национальных регистров. Имеющийся клинический материал, значительный период наблюдения за больными позволяют проанализировать собственный опыт радикального хирургического лечения больных злокачественными опухолями МП в практике специализированного стационара – ГБУЗ «Областной онкологический диспансер» г. Иркутска.
Нами была поставлена цель: на основании изучения результатов 5-летней выживаемости (общей, скорректированной, безрецидивной и безрецидивной скорректированной) и анализа послеоперационных осложнений оценить эффективность радикального хирургического лечения больных РМП (T1-T4b), включающего проведение одномоментной радикальной цистэктомии с различными методами реконструкции нижних мочевых путей.
Материалы и методы исследования
Изучены непосредственные и отдаленные результаты одномоментной радикальной цистэктомии (РЦЭ), выполненной в отделении урологии ГБУЗ «Областной онкологический диспансер» у 277 больных по поводу РМП (T1-T4b). Возраст больных находился в пределах от 34 до 82 лет (медиана 59; интерквартильный диапазон от 50 до 66 лет; 95 % ДИ: [57,0–59,4]). В возрастной структуре пациентов преобладали больные РМП в возрасте от 60 до 69 лет – 38,6 %, далее следовала возрастная группа от 50 до 59 лет – 28,9 %, на третьем месте были больные в возрасте от 40 до 49 лет – 18,4 %. Мужчин было 232 (83,8 %), женщин 45 (16,2 %). Опухоль, ограниченная МП, диагностирована у 152 (54,9 %) пациентов: рТ1 – 22,7 %, рТ2а – 17,0 %, pT2b-15,2. Опухоль МП распространялась за пределы органа у 125 (45,1 %) пациентов: pT3a – 13,7 %, pT3b – 14,4 %, pT4a – 15,5 %, pT4b – 1,4 %. Метастатическое поражение регионарных лимфатических узлов (ЛУ) выявлено у 45 (16,2 %). Отдаленные метастазы (М1) в 9 (3,2 %) случаях. По гистологической градации случаи низкодифференцированного рака отмечены – у 48,4 %, высоко и умеренно дифференцированные опухоли МП зарегистрированы в 10,1 % (G1) и 41,5 % (G2) случаях соответственно.
Для реконструкции нижних мочевых путей после РЦЭ использовали различные сегменты желудочно-кишечного тракта: накожное инконтинентное отведение мочи (операция Бриккера) выполнено у 70 (25,3 %) больных; наружное отведение мочи с созданием влажной стомы (уретерокутонеостомия, далее УКС) – у 148 (53,4 %); внутреннее отведение мочи в непрерывный кишечник (уретеросигмостомия, далее УСС) – у 12 (4,3 %); отведение мочи в сигморектальный резервуар (по Mainz pouch-2) – у 13 (4,7 %) больных; ортотопическое отведение мочи в сформированный кондуит из сигмовидной кишки (по Reddy) – у 12 (4,3 %); ортотопическая пластика мочевого пузыря (илеоцистопластика по Штудеру) – в 16 (5,8 %) случаях, ортотопическая и гетеротопическая пластика желудком по Митчеллу у 4 (1,4 %) и 2 (0,7 %) больных соответственно. Следует отметить, что УКС и УСС, выполненные у 160 (57,8 %) больных, чаще применяли в период освоения методики и у ослабленных больных. Во многих случаях этот метод деривации мочи был выбран пациентом (низкий уровень комплаенса).
Основные результаты исследования представлены с использованием доверительных интервалов, включающих истинное значение рассматриваемого параметра во всей популяции с вероятностью 95 %. Все анализируемые в работе показатели были формализованы и введены в единую электронную базу данных. Их статистическая обработка проводилась с помощью программ: Statistica 6.0; Statistica 7.0 (StatSoft, USA); SPSS 16.0 (SPSS Inc., USA); Microsoft Excel 2003 (Microsoft Corporation, USA). При проверке гипотез использовался 5 % уровень значимости. При анализе 5-летней выживаемости использовали общепринятые методы, рекомендованные Московским научно-исследовательским онкологическим институтом им. П.А. Герцена – это прямой метод расчета выживаемости и актуриальные методы [3].
Результаты исследования и их обсуждение
Интраоперационные осложнения зарегистрированы у 6 (0,8 %) оперированных: ранение прямой кишки – у 9 (3,2 %) пациентов, профузное кровотечение из варикозно расширенных вен таза – у 5 (1,8 %) и острая сердечно-сосудистая недостаточность – у 6 (2,2 %) пациентов. Смерть в течение 30 дней после радикальной хирургии наступила у 17 больных, послеоперационная летальность составила 6,1 %. Во время операции скончались 2 (0,7 %) пациента, причиной смерти явились кровотечения и последующая острая сердечно-сосудистая недостаточность.
После 277 РЦЭ в раннем послеоперационном периоде зарегистрировано 119 (43,0 %) осложнений у 88 (31,8 %) пациентов. В 38 (13,7 %) случаях потребовалось выполнение повторного хирургического вмешательства. В структуре ранних осложнений превалировали: обострение хронического пиелонефрита – у 23 (8,3 %) больных; перитонит и эвентерация кишечника – у 14 (5,1 %); нагноение послеоперационной раны – у 11 (4,0 %); несостоятельность межкишечного анастомоза – у 7 (2,5 %). Ранние послеоперационные осложнения встречались при всех видах отведения мочи за исключением гетеротопической пластики желудком по Митчеллу.
Из поздних послеоперационных осложнений возникших у 137 (52,7 %) пациентов, представительной группой являлись: камни мочевыводящих путей – у 33 (13,0 %) больных, стенозирование стом – у 5 (1,9 %), острый и обострение хронического пиелонефрита – у 11 (4,2 %) и 16 (6,2 %) больных соответственно; послеоперационная грыжа передней брюшной стенки – у 7 (2,7 %); стриктура уретро-кишечного соустья – у 3 (1,2 %); стриктура уретеро-кишечного соустья – у 6 (2,3 %); спаечная кишечная непроходимость – у 10 (3,8 %); лимфоцеле – у 4 (1,5 %); кишечные свищи – 4 (1,5 %) больных. Применение оперативных методов лечения при возникновении поздних послеоперационных осложнений потребовалось у 58 (22,3 %) больных.
Продолжительность одномоментной РЦЭ с различными вариантами отведения мочи составила: средняя 235,3 мин, мода 250; минимум 102; 1 – квартиль 150; медиана 240; 3 – квартиль 300; максимум 645; размах 543 (95 % ДИ: [223,6–246,8]).
Интраоперационная кровопотеря не зависела от метода отведения мочи и составила: средняя 1639,9 мл, мода 1000; минимум 100; 1 – квартиль 800; медиана 1600; 3 – квартиль 2400; максимум 5800; размах 5700 (95 % ДИ: [1525,5–1754,3]). Установлено, что средний объем интраоперационной кровопотери при выполнении РЦЭ до 2005 г. составил 2228,9 ± 1118,9 мл. (95 % ДИ: [1998,5–2459,4]), а после 2005 г. 1342,2 ± 718,6 мл. (95 % ДИ: [1237,6–1446,7]).
Местные рецидивы чаще возникали в малом тазу – у 21 (37,5 %), в регионарные лимфатические узлы – у 11 (19,6 %) пациентов. Отдаленными метастазами были поражены легкие, печень и кости – у 18 (32,1 %) больных. Возникновение рецидивов в верхних отделах мочевого тракта мы наблюдали реже – у 6 (10,7 %) больных. Длительность безрецидивного периода (мес.): среднее 23,3; мода множ.; минимум 5,6; 1 – квартиль 13,5; медиана 22,1; 3 – квартиль 34,0; максимум 49,5; размах 43,9 (95 % ДИ: [20,3–26,4]).
Общая 5-летняя выживаемость больных, включенных в исследование, составила 51,6 % (n = 143), медиана времени жизни – 16,9 мес. (рис. 1).
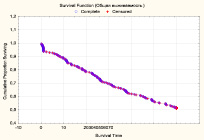




Рис. 1. Общая 5-летняя выживаемость больных после РЦЭ (Каплан-Майер)
Скорректированный (поправленный) показатель 5-летней выживаемости больных РМП после РЦЭ составил 88,7 % (n = 795). От прогрессирования основного заболевания в течение пяти лет скончалось 49 (17,7 %) пациентов (рис. 2).
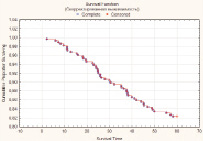



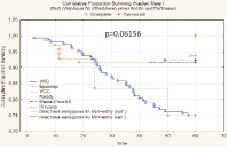
Рис. 2. Скорректированная 5-летняя выживаемость больных после РЦЭ (Каплан‒Майер)
Лучшие показатели скорректированной выживаемости достигнуты при РМП с глубиной инвазии опухоли T1 (95,2 %) и T2b (92,9 %). При опухолевой инвазии поверхностного мышечного слоя (Т2а) данный показатель составил 89,4 %. В случае инвазии опухоли за пределы МП с прорастанием в паравезикальную клетчатку (рТ3) скорректированная 5-летняя выживаемость снижалась до 71,1 %, при pT3b ‒ до 77,5 %, а при опухолевой инвазии соседних органов (pT4a) ‒ до 60,5 % и при распространении онкологического процесса на стенку таза или брюшную стенку ‒ до 75,0 %. Различия между сравниваемыми выборками признаны статистически значимыми (p = 0,00004).
Статистически значимые результаты получены при изучении зависимости скорректированной пятилетней выживаемости от степени вовлечения в онкологический процесс ЛУ: pN0 – 85,8 %, pN1 – 50,0 %, pN2 – 67,8 %, при pN3 размер выборки недостаточный (p = 0,00579). Установлено, что метод реконструкции мочевого резервуара не оказывает статистически значимого влияния на показатель 5-летней скорректированной выживаемости больных РМП (р = 0,06156).
Показатель 5-летней общей безрецидивной выживаемости после радикального хирургического лечения РМП (n = 277) составил 48,1 % (n = 133) и имел выраженную тенденцию к улучшению при глубине инвазии РМП T1 (85,7 %) и Т2а (72,3 %), а также при отсутствии регионарного (56,9 %) и отдаленного (49,6 %) метастазирования. При всех анализируемых выборках больных различия признаны статистически значимыми. Медиана времени жизни – 24,8 месяца. Установлено, что метод реконструкции мочевого резервуара оказывает статистически значимое влияние на показатель 5-летней безрецидивной выживаемости больных РМП (T1-T4b), р = 0,000001 (рис. 3).
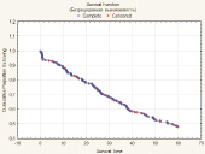

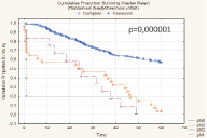
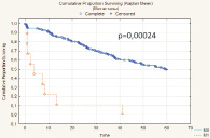
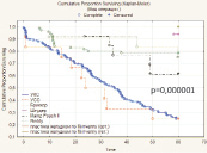
Рис. 3. Общая безрецидивная выживаемость больных после РЦЭ (Каплан‒Майер)
Наиболее точным показателем, отражающим излеченность от РМП, является безрецидивная скорректированная выживаемость. Безрецидивная скорректированная 5-летняя выживаемость составила 78,7 % (n = 218), медиана выживаемости 29,6 мес. (рис. 4).
Высокая безрецидивная скорректированная выживаемость отмечена у больных с опухолями, ограниченными мочевым пузырем – 89,8 %. При распространении опухоли за пределы мочевого пузыря этот показатель значительно снижался до 67,2 %. При прорастании опухоли в поверхностную мышцу (T2a) 5-летняя безрецидивная скорректированная выживаемость после цистэктомии составила 87,2 %, а при инвазии глубокого мышечного слоя (T2b) – 90,5 %. В случае инвазии опухоли за пределы МП с макроскопическим прорастанием в паравезикальную клетчатку (рТ3b) 5-летняя безрецидивная скорректированная выживаемость снижалась до 67,5 %. Аналогичная тенденция отмечена и при изучении зависимости 5-летней безрецидивной скорректированной выживаемости от степени поражения регионарных лимфоузлов. Выполнение в ходе РЦЭ регионарной лимфодиссекции позволяло при единичных и множественных регионарных метастазах добиться пятилетней безрецидивной скорректированной выживаемости, сравнимой с выживаемостью пациентов с интактными лимфоузлами, однако полученные различия не имели статистической значимости (p = 0,06703).


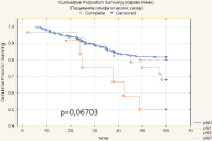
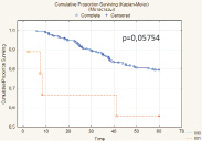
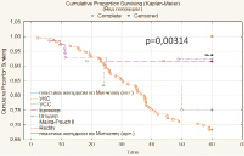
Рис. 4. Безрецидивная скорректированная выживаемость больных после РЦЭ (Каплан‒Майер)
Несмотря на крайне низкую общую (наблюдаемую) пятилетнюю выживаемость больных РМП после РЦЭ с последующей уретрокутанео- и уретросигмостомией (28,4 % и 25,0 % соответственно), были достигнуты приемлемые показатели скорректированной (75,0 и 75,0 % соответственно) и безрецидивной скорректированной (68,2 и 75,0 % соответственно) выживаемости. Столь низкие показатели общей пятилетней выживаемости больных РМП связаны с неблагоприятными онкологическими характеристиками, наличием тяжелой интеркурентной патологии и преклонным возрастом больных.
Выводы
Таким образом, выполнение одномоментной радикальной цистэктомии с различными методами отведения мочи обеспечивает общую – 51,6 % (медиана выживаемости 16,9 мес.), скорректированную – 88,7 % (медиана выживаемости 26,5 мес.), безрецидивную – 48,1 % (медиана выживаемости 24,8 мес.) и безрецидивную скорректированную – 78,7 % (медиана выживаемости 29,6 мес.) выживаемость больных РМП (T1-T4b). Неблагоприятными факторами, оказывающими влияние на показатели общей выживаемости, являются распространение онкологического процесса за пределы органа, поражение лимфатических узлов и метастатическое распространение процесса. Использование для реконструкции нижних мочевых путей после РЦЭ современных пластических методик позволило добиться статистически значимого повышения 5-летней безрецидивной выживаемости больных РМП (T1-T4b) с 25,0 % после УКС и 75,0 % после УСС до 78,6 % после операции Bricker, до 93,8 % после Studer, до 61,5 % после Mainz pouch II, до 75,0 % после Reddy и до 100,0 % после ортотопической и гетеротопической пластики желудком по Митчеллу (р = 0,000001) и безрецидивной скорректированной выживаемости с 68,2 % после УКС и 75,0 % после УСС до 91,4 % после операции Bricker, до 93,8 % после Studer, до 92,3 % после Mainz pouch II, до 91,7 % после Reddy и до 100,0 % после ортотопической и гетеротопической пластики желудком по Митчеллу (p = 0,00314). Метод реконструкции мочевого резервуара не оказывает статистически значимого влияния на показатель 5-летней скорректированной выживаемости больных РМП (р = 0,06156).
Наиболее высокие показатели 5-летней выживаемости отмечаются у больных с опухолями, ограниченными МП, скорректированная 5-летняя выживаемость – 95,2 %. При распространении опухоли МП за пределы органа данный показатель снижается при pT2a до 89,4 %, pT3a до 71,1 %, pT3b до 77,5 %, pT4a до 60,5 % и при pT4b до 75,0 % (р = 0,00004).
Рецензенты:
Дворниченко В.В., д.м.н., профессор, заведующая кафедрой онкологии, ГБОУ ВПО ИГМУ Минздрава России, Российская Федерация, г. Иркутск;
Лалетин В.Г., д.м.н., профессор кафедры онкологии и лучевой терапии, ГБОУ ВПО ИГМУ Минздрава России, Российская Федерация, г. Иркутск.
Работа поступила в редакцию 15.01.2014.



