Изменение экологической ситуации затрагивает вопросы здоровья и адаптивных возможностей населения различных возрастов [2]. Увеличение патологий обусловлено не только постоянным загрязнением окружающей среды, но и циркуляцией в ней ряда элементов, уже включенных в пищевые цепи, например, тяжелых металлов (ТМ). В ранее проведенных исследованиях выявили превышение допустимого уровня содержания ТМ в сыром молоке ряда населенных пунктов Ставропольского края [3]. Эти элементы, попадая и накапливаясь в организме, являются биохимической основой нарушения ряда функций организма [1, 5]. Одними из первых воздействию ТМ подвергаются липиды как основной элемент живых организмов с образованием продуктов перекисного окисления липидов (ПОЛ) [6]. Пищевые продукты, загрязненные ТМ, являются не только источниками поступления в организм ТМ, но и причиной биохимической трансформации продуктов со снижением их качества и накоплением продуктов ПОЛ. Остается открытым вопрос особенностей влияния тяжелых металлов на ПОЛ.
Целью исследования было выявить закономерности изменения ПОЛ в липидной модельной системе в зависимости от специфики ТМ и уровня концентрации (ПДК) на примере свинца и кадмия.
Материалы и методы исследования
Основные исследования проводили в модельной системе путем внесения заданной концентрации тяжелых металлов. Для этого использовали суспензию липопротеидов желтка (ЖЛП) куриных яиц, помещенную в среду культивирования с оптимальной величиной рН для проведения реакции перекисного окисления липидов в соответствии с моделью, описанной ранее [4]. Использован подход, описанный Замбржицким О.Н. и соавторами: для приготовления модельной системы из куриного яйца выделяли желток, подсушивали его на фильтровальной бумаге, а затем растворяли в равном объеме фосфатного буфера (40 мМ КН2РО4 + 105 мМ КCI, рН 7,5). Полученную суспензию ЖЛП перед использованием разводили в 25 раз тем же буфером. Суспензию можно хранить при 4 °С в течение недели.
Исследования проводили следующим образом: к 0,5 мл образца исследуемого продукта добавляли 1 мл суспензии ЖЛП, затем 3 мл 1 % ортофосфорной кислоты (рН 2,0). Перекисное окисление липидов во всех пробах инициировали добавлением 0,1 мл раствора сернокислого железа (30 мг FeSO4×7H2O в 10 мл дистиллированной воды). Контрольная проба не содержала образцов исследуемого продукта. Пробы тщательно перемешивали и инкубировали в термостате на водяной бане при 37 °С в течение 20 мин.
Скорость перекисного окисления липидов определяли по количеству накопившихся ТБК-продуктов (малоновый диальдегид), реагирующих с тиобарбитуровой кислотой (ТБК). Для этого в каждую пробирку после культивирования добавляли по 1 мл 0,6 % тиобарбитуровой кислоты. Содержимое пробирок снова перемешивали и помещали на кипящую водяную баню на 20 минут. Далее пробирки охлаждали, добавляли по 4 мл бутанола, тщательно перемешивали и центрифугировали 10 мин при 3000 об/мин. Оптическую плотность верхней (бутанольной) фазы измеряли при 540 нм с помощью спектрофотометра СФ-46. В качестве контроля использовали чистый бутиловый спирт. Расчет содержания продуктов, реагирующих с ТБК, проводили с учетом коэффициента молярной экстинции малонового диальдегида, равного 1,56∙105 моль∙см–1:
А = Еоп∙106∙4 мл/1,56∙105∙0,5 мл = Еоп∙51,3,
где А – содержание МДА (в мкмоль/л или нмоль/мл); 4 мл – объем бутанольной фазы; 0,5 мл – объем пробы исследуемого продукта; Еоп – оптическая плотность, измеренная в образцах и контроле.
Антиоксидантную активность (АОА) исследуемого продукта рассчитывали по формуле
АОА(%) = (Еконтр – Еобр/Еконтр)∙100,
где АОА – антиоксидантная активность исследуемого продукта в (%); Еконтр и Еобр – оптическая плотность, измеренная в образцах и контроле.
Оценивали уровень ТБК-активных продуктов с использованием стандартных диагностических наборов (ТБК-Агат, Россия) в соответствии с инструкцией к набору. В отдельных исследованиях содержание АОА контролировали амперометрическим методом на приборе «ЦветЯуза-01-АА» в соответствии с аттестованными методиками (МВИ 31-07 и МВИ 120-08), инструкцией к прибору и ГОСТ Р 54037-2010; ГОСТ Р 54036-2010 (в расчете на галловую кислоту).
При моделировании загрязнения тяжелыми металлами исходили из норм определяемых Федеральным законом от 12.06.2008 № 88-ФЗ «Технический регламент на молоко и молочную продукцию» допустимый уровень содержания в сыром молоке свинца 0,1 мг/л, а кадмия 0,03 мг/л, что соответствует ПДК (предельно допустимая концентрация). В эксперименте рассматривались как предельно допустимые уровни, так и превышение допустимого уровня тяжелых металлов в два и десять раз (Cd – 0,03 мг/л (ПДК); 0,06 мг/л (2 ПДК); 0,3 мг/л (10 ПДК) и Pb – 0,1 мг/л (ПДК); 0,2 мг/л (2 ПДК); 1 мг/л (10 ПДК)). Все эксперименты проведены в 3-кратной повторности.
Для подтверждения специфичности действия ТМ сравнивали действие свинца и кадмия в модели in vivo. Исследование проводилось на 21 крысе-самце линии Вистар. Для проведения исследования было сформировано три группы животных: 1-я (контрольная) группа – крысы, получавшие питьевую воду; 2-я и 3-я группы – животные, получавшие 1 месяц питьевую воду с хлоридом кадмия и свинца в дозе 50 ppm соответственно. Питьевая вода с данными растворами давалась животными ad libitum. Кровь забиралась из хвостовой вены через месяц эксперимента под эфирным наркозом. Содержание продуктов перекисного окисления липидов определяли в соответствии с инструкцией набора реактивов «ТБК – Агат». Все результаты обрабатывались с использованием статистических методов в соответствии с типом распределения данных.
Результаты исследования и их обсуждение
В модельном эксперименте добавление различных концентраций тяжелых металлов в инкубационную среду с липидами желтка выявило изменение уровня перекисного окисления в зависимости от вида тяжелого металла. Добавление свинца на уровне одного ПДК приводило к максимальному повышению ТБК-активных продуктов, сохранявшемуся в пробах с увеличенной концентрацией металла до 2 и 10 ПДК соответственно. В модельной системе с растворами кадмия изменение в окислении липидов зависело от концентрации ионов данного металла. Достижение максимального уровня ТБК-активных продуктов соответствовало ПДК свинца. Следует отметить, что аналогичное повышение ТБК-активных продуктов в модельной системе достигается при концентрации ионов кадмия, соответствующей 10 ПДК (рис. 1).
В системах с моделированием загрязнения образцов сырого молока исследуемыми концентрациями тяжелых металлов приводило к иному уровню окислительных процессов. Общий уровень образования перекисей в молоке был значительно ниже, поскольку собственная антиоксидантная система молока способна снижать перекисные процессы [7]. Содержание ТБК-активных продуктов в молоке не зависело от дозы внесения свинца и кадмия, а определялось типом металла. Кадмий в сравнении со свинцом усиливал образование перекисей в два раза (рис. 2).
Оценка общей АОА сыворотки молока (после осаждения белков) амперометрическим методом по эквиваленту галловой кислоты показал отсутствие различий в пробах молока с различной концентрацией свинца. Пробы сыворотки молока, загрязненного кадмием, снижали антиоксидантную активность пропорционально повышению концентрации кадмия (рис. 3). Выявленная закономерность указывает на участие в механизмах антиоксидантной защиты белков молока, что может быть обусловлено особенностью связывания белками молока ионов тяжелых металлов. Показано, что распределение добавленного кадмия в молочной системе происходит неодинаково: 96 % находится в молочной фракции, а 3 % связано с жировой фракцией. Кадмий не связывается ни с одной белковой фракцией [8]. Свинец связывается с одним из основых белков молока – казеином. С использованием спектроскопии Рамана установлены два сайта связывания свинца с альфа-казеином с возможным участием сульфгидрильных групп цистеина [9].
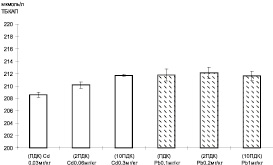
Рис. 1. Уровень ТБК-активных продуктов в модельной системе в зависимости от концентрации тяжелых металлов: светлые столбцы – кадмий, темные столбцы – свинец
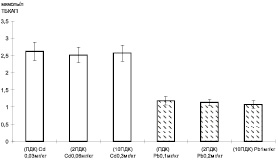
Рис. 2. Уровень ТБК-активных продуктов в модельной системе с добавлением сырого молока в зависимости от концентрации тяжелых металлов: светлые столбцы – кадмий, темные столбцы – свинец
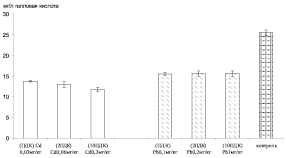
Рис. 3. Общая АОА сыворотки молока (после осаждения белков), загрязненного тяжелыми металлами: светлые столбцы – кадмий, темные столбцы – свинец (в пересчете на концентрацию галловой кислоты)
Сравнительный анализ уровня ТБК-активных продуктов в плазме крови крыс показал, что употребление воды с одинаковой концентрацией исследуемых тяжелых металлов вызвало достоверный рост количества перекисей в плазме крови у крыс. При этом у животных, употреблявших раствор хлорида кадмия значимо была повышена концентрация перекисей в сравнении с группой, употреблявших раствор хлорида свинца (рис. 4).
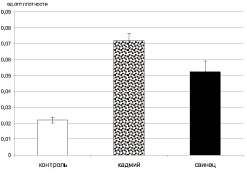
Рис. 4. Уровень ТБК-активных продуктов в плазме крови крыс (в ед. опт. плотности)
Выводы
1. В модельной реакции перекисного окисления с липидами желтка яиц тяжелые металлы инициировали интенсивное окисление липидов. Образование ТБК-активных продуктов в присутствии свинца не зависело от концентрации, а кадмий увеличивал процессы перекисного окисления в зависимости от его уровня.
2. В сыром молоке количество ТБК-активных продуктов выше в пробах, загрязненных кадмием, чем свинцом. Рост ТБК-активных продуктов независимо от концентрации указывает на вовлеченность антиоксидантной системы молока и бóльшую окислительную активность ионов кадмия.
3. Осаждение белков молока выявило различное накопление перекисей в зависимости от концентрации металла. Пробы, содержащие свинец, проявляли одинаковую окислительную активность при концентрации от одного до десяти ПДК. Кадмий в отсутствии белка усиливал окислительные процессы с ростом ПДК. Данные различия могут быть связаны с интенсивностью взаимодействия тяжелых металлов с сульфгидрильными группами белков молока.
4. Статистически достоверный рост ТБК-активных продуктов в плазме крови наблюдался у крыс, получавших в течение 1 месяца хлорид кадмия 50 ppm в питьевой воде, в сравнении с животными, получавшими хлорид свинца.
Рецензенты:
Джандарова Т.И., д.б.н., доцент, профессор кафедры анатомии и физиологии, ФГАОУ ВПО «Северо-Кавказский федеральный университет» Минобрнауки РФ, г. Ставрополь;
Цатурян Л.Д., д.м.н., заведующий кафедрой нормальной физиологии, ГБОУ ВПО «Ставропольский государственный медицинский университет» Министерства здравоохранения РФ, г. Ставрополь.
Работа поступила в редакцию 30.12.2013.



