Как типичный патологический процесс, ремоделирование сетчатки наблюдается при различных ее заболеваниях. Критическую роль в этом процессе играют глиальные элементы, их реактивность в значительной степени определяет паттерн структурных изменений хориоретинального комплекса [2]. Метаболические нарушения, происходящие при сахарном диабете уже на ранних этапах течения заболевания, сопровождаются реорганизацией сетчатки, происходящей на тканевом и клеточном уровне. С точки зрения изучения процесса ремоделирования интересна роль глиальных элементов сетчатки, в частности, радиальных глиоцитов, которые осуществляют активный транспорт метаболитов, поддерживают гомеостаз калия, выполняют также барьерную, опорную, изолирующую функции, играют роль в развитии дегенеративных и репарационных процессов [4, 7, 11, 12].
Цель исследования – изучение морфологических изменений радиальных глиоцитов и их вклада в процесс ремоделирования сетчатки при экспериментальном сахарном диабете.
Материалы и методы исследования
Эксперименты проведены на 20 белых половозрелых крысах самцах породы Wistar. Животным (n = 10) воспроизводили сахарный диабет путем однократного внутрибрюшинного введения стрептозотоцина в дозе 15 мг/100 г массы тела. Критерием тяжести заболевания служили уровень гипергликемии (свыше 15 ммоль/л), потеря массы тела, выраженность полиурии и полидипсии. Контролем (n = 10) служили интактные животные, которых содержали в идентичных условиях вивария. Декапитацию производили под эфирным наркозом через 2 месяца после введения стрептозотоцина, в аналогичные сроки производили взятие контрольного материала. Центральные участки задней стенки глаза фиксировали в растворе, содержащем смесь 4 % параформальдегида и 0,5 % глютаральдегида на 0,2 М какодилатном буфере (рН 7,4). Материал постфиксировали в 2 % растворе четырехокиси осмия и заливали в эпон. Полутонкие срезы окрашивали толуидиновым синим, ультратонкие контрастировали уранилацетатом и цитратом свинца, просматривали и фотографировали в электронном микроскопе JEM-7 А. Для изучения филаментозных образований субсинаптических единиц сетчатки контрастировали в 5 % растворе фосфорно-вольфрамовой кислоты (ФВК) на абсолютном спирте в течение 3 часов и заливали в эпон. Для оценки изменений синаптоархитектоники фотографировали по 10 случайно выбранных полей зрения внутреннего сетчатого слоя с 5 срезов каждой сетчатки при стандартном увеличении 8500. На фотографиях при конечном увеличении 30000 определяли количество межнейронных контактов (площадь поля зрения – 50 мкм²) и высчитывали численную плотность синапсов на 100 мкм² нейропиля. Длину активной зоны контакта определяли с помощью тестовой решетки с шагом 3 мм. На полутонких срезах производили подсчет пикноморфных радиальных глиоцитов на 200 клеток, определяли глионейрональный индекс во внутреннем ядерном слое. Статистическую обработку результатов проводили методами вариационной статистики. Для оценки достоверности различий при сравнении средних величин использовали непараметрический критерий Манна‒Уитни.
Результаты исследований и их обсуждение
Через 2 месяца после введения стрептозотоцина у крыс наблюдается сохранность структурной организации сетчатки. Нейроны внутреннего ядерного слоя при стрептозотоциновом диабете длительностью 2 месяца остаются относительно интактны. Их изменения носят преимущественно реактивный характер, характеризующийся уменьшением числа полисом, фрагментацией и набуханием цистерн гранулярной ЭПС, деструкцией митохондрий. Аналогичные изменения наблюдаются и в центральных отростках ассоциативных нейронов, которые располагаются во внутреннем сетчатом слое и образуют с дендритами ганглионарных нейронов синаптические контакты, при этом число последних снижается относительно контрольных значений в 4 раза (р < 0,05, контроль, 20,00 ± 0,45 на 100 мкм2 нейропиля). Между отечными нервными отростками во внутреннем сетчатом слое выявляются гипертрофированные отростки радиальных глиоцитов. Такое глионейрональное взаимодействие, возможно, улучшает трофику нейронов и способствует реорганизации нейропиля. Так, на фоне дегенерации синапсов с малой длиной активной зоны контакта в 3 раза возрастает число усложненных гипертрофированных контактов (р < 0,05, контроль, 0,98 ± 0,10 на 100 мкм2 нейропиля).
Для изучения взаимодействия ассоциативных нейронов и радиальной глии был использован показатель глионейронального индекса (ГНИ), который снижается в 1,8 раза по сравнению с контролем (p < 0,05), что, возможно, связано с гибелью глиоцитов (таблица). В условиях ишемии наблюдается повышенная стимуляция нейронов, которые синтезируют большие количества глутамата и калия [6, 8]. Возможно, глутамат токсически действует не только на нейроны, но и на глию сетчатки, вызывая ее гибель. Так, преимущественно на границе между наружным сетчатым и внутренним ядерным слоями наблюдается деструкция глиоцитов. Часть клеток подвержена выраженным дегенеративным изменениям митохондрий, цистерн эндоплазматической сети и комплекса Гольджи, что способствует вакуольному перерождению цитоплазмы. Грубые нарушения липопротеидных комплексов мембран вследствие гипоксии, вызванной сосудистыми нарушениями, характерными для диабета, приводят к потере клеткой воды и сморщиванию, что сопровождается конформационными изменениями белков клетки. Это выражается в повышении осмиофилии цитоплазмы и кариоплазмы при продолжающемся уменьшении органелл (рис. 1). Число пикноморфных радиальных глиоцитов относительно интактного контроля увеличивается в 2 раза (p < 0,05) (таблица).
Количественный анализ изменений радиальных глиоцитов сетчатки при стрептозотоциновом диабете
|
Группы эксперимента |
Пикномофные радиальные глиоциты (%) |
Глионейрональный индекс (ГНИ) |
|
Контроль |
2,1 ± 0,33 |
0,37 ± 0,01 |
|
Диабет |
4,22 ± 0,42* |
0,21 ± 0,02* |
Примечание: * – достоверность различий (p < 0,05) при сравнении с показателями контрольных животных.
Однако помимо деструктивных изменений радиальных глиоцитов возрастает количество реактивно измененных клеток, характеризующихся снижением электронной плотности, вакуолизацией цитоплазмы, отеком склеральных отростков. По данным литературы, радиальные глиоциты более склонны к набуханию, чем нейроны, так как они осуществляют транспорт воды, образующейся в результате функционирования нейронов [3]. Склеральные отростки радиальных глиоцитов гипертрофированы, в их цитоплазме содержатся лизосомы, фагосомы с частицами фоторецепторных элементов, вакуоли (рис. 2). В некоторых участках отростки прорастают в наружные слои сетчатки и замещают погибшие фоторецепторы. Активирует пролиферацию глии, в частности, повышенный вход в клетку ионов кальция [9]. В патологических условиях транспорт Ca2+ усиливает аденозин, количество которого увеличено на 300 % при гипоксии сетчатки [10]. Сохранившиеся фоторецепторы, а также ассоциативные нейроны окружены глиальными пластинами, изолирующими неповрежденные элементы сетчатки и, возможно, оказывающие нейротрофическое действие [5]. Подобные структуры обнаруживались также при фотоповреждении сетчатки [1].
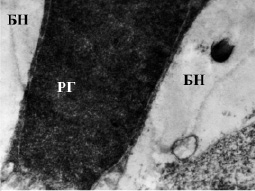
Рис. 1. Пикноморфный радиальный глиоцит между отечными биполярными нейронам во внутреннем ядерном слое сетчатки крыс со стрептозотоциновым диабетом. Электронограмма. Ув. 10000. РГ – радиальный глиоцит; БН – биполярный нейрон
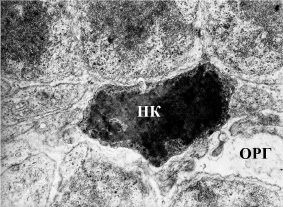
Рис. 2. Гипертрофия склеральных отростков радиальных глиоцитов сетчатки крыс со стрептозотоциновым диабетом, пикноз нейросенсорной клетки, электронограмма. Ув. 3500. ОРГ – отросток радиального глиоцита, НК – нейросенсорной клетки
Заключение
Реакция радиальной глии при стрептозотоциновом диабете характеризуется выраженной пролиферацией отростков, которые изолируют неизмененные клеточные элементы и оказывают стимулирующее влияние на реорганизацию синаптического аппарата сетчатки, что является отражением адаптационных процессов при раннем ремоделировании сетчатки.
Рецензенты:
Солонский А.В., д.м.н., руководитель лаборатории нейробиологии, ФГБУ «Научно-исследовательский институт психического здоровья» СО РАМН, г. Томск;
Геренг Е.А., д.м.н., доцент кафедры морфологии и общей патологии, ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, г. Томск.
Работа поступила в редакцию 15.01.2014.



