В последнее время все большую актуальность приобретает проблема лечения заболеваний предстательной железы. Доброкачественная гиперплазия простаты (ДГП) и хронический простатит (ХП) являются одними из наиболее распространенных урологических заболеваний у мужчин [9, 11, 12]. Современные схемы лечения сочетают простатопротекторы различных фармакотерапевтических групп, среди которых ведущее место занимают фитопрепараты. Они проявляют выраженную терапевтическую активность, имеют меньший спектр побочных реакций по сравнению с синтетическими лекарственными средствами. Механизм действия препаратов, содержащих растительное сырье, связан со способностью ингибировать активность фермента 5α-редуктазы, уменьшать процессы пролиферации и положительно влиять на функцию мочевыделения [1, 3, 5, 6, 8].
Среди простатопротекторов, которые представлены на фармацевтическом рынке Украины, отсутствуют фитопрепараты производства Украины в виде суппозиториев – наиболее оптимальной лекарственной формы для лечения заболеваний предстательной железы [2, 4].
К преимуществам суппозиториев относятся: поступление лекарственных веществ непосредственно в системный кровоток, высокая скорость всасывания лекарств, устранение неприятных органолептических свойств, снижение аллергизирующего действия препарата, возможность уменьшения дозы лекарственного вещества по сравнению с приемом per os.
В Национальном фармацевтическом университете на кафедре заводской технологии лекарств (под руководством профессора Рубан Е.А.) разработана новая фитокомпозиция в виде суппозиториев для лечения заболеваний предстательной железы, которая содержит растительные экстракты плодов пальмы сабаль, корня крапивы и семян тыквы.
Экстракт плодов пальмы сабаль – неконкурентный ингибитор 5-альфа-редуктазы растительного происхождения. Он проявляет антиэкссудативное, противовоспалительное, антиандрогенное действие, устраняет дизурические расстройства. Экстракт корня крапивы ингибирует фермент ароматазу, которая катализирует метаболизм тестостерона при его превращении в 17-эстрадиол, что стимулирует пролиферацию предстательной железы. Также экстракт уменьшает активность мембранной Na/K – ATФазы, в результате чего замедляется обмен веществ в клетках предстательной железы и вместе с этим ее рост. Сухой экстракт семян тыквы проявляет цитопротекторный, антиоксидантный эффекты, подавляет пролиферацию клеток предстательной железы, снижает болевой синдром, возобновляет функциональную активность предстательной железы, предотвращает снижение половой функции и фертильности у мужчин [10]. Суппозиторная основа (твердый жир) обеспечивает эффективное высвобождение действующих веществ, повышает их биодоступность.
Целью наших исследований стало обоснование технологии изготовления новых суппозиториев с растительным сырьем для лечения заболеваний предстательной железы. Для этого был проведен термогравиметрический анализ действующих компонентов и суппозиториев, а также реологические исследования вязкости суппозиторной массы и основы с целью определения оптимального температурного режима ведения технологического процесса без опасности разрушения структуры субстанций и изменения фармакологического эффекта препарата.
Материалы и методы исследования
Термогравиметрические исследования проводились на дериватографе Q – 1000 системы Ф. Паулик, И. Паулик, Л. Ефдей с платино-платинородиевой термопарой при нагревании образцов в керамических тиглях от 18 до 500 °С на воздухе. Скорость нагревания составляла 5 °С за минуту. Эталоном служил прожаренный оксид алюминия. Вес образцов составлял 50 мг. Фиксировали кривые Т (изменения температуры), ТГ (изменения веса), ДТА (дифференцированная кривая изменения тепловых эффектов), ДТГ (дифференцированная кривая изменения веса) [7, 13].
Реологические исследования проводили на ротационном вискозиметре Myr V2 – R (Viscotech, Испания). Вязкость измеряли с помощью шпинделей R 3 и R 4 при скорости вращения 200 об/мин., единицы измерения мПа·с.
Результаты исследования и их обсуждение
На рис. 1 представлена дериватограмма сухого экстракта семян тыквы. Как видно из рисунка, процесс разложения экстракта начинается при температуре 62 °С. В интервале температур 62–175 °С образец теряет 7 % массы (кривая ТГ). Затем процесс разложения ускоряется и при температуре 175–230 °С потеря массы составляет 4 %. На кривой ДТА (температура 175–230 °С) наблюдается экзотермический процесс, который свидетельствует о выгорании образца.
На рис. 2 приведена дериватограмма сухого экстракта корня крапивы. Как видно из рисунка, до температуры 49 °С потери массы не наблюдается. В интервале температур 165–195 °С разложение образца ускоряется и приобретает максимальную скорость при температуре 195 °С (кривая ДТГ), наблюдается слабо выраженная экзотермическая реакция.
Анализируя дериватограмму сухого экстракта плодов пальмы сабаль (рис. 3), можно сделать вывод, что потеря массы начинается при температуре 105 °С. В интервале температур 105–175 °С образец теряет 2 % от навески (кривая ТГ), в интервале температур 175–205 °С – 3 % (ярко выражена экзотермическая реакция). На рис. 4 приведена дериватограмма суппозиториев с растительными экстрактами. Как видно из рисунка, до температуры 107 °С потери массы не наблюдается (кривая ТГ). В интервале температур 107–218 °С потеря массы составляет 2,5 %. При температуре 218 °С прослеживается интенсивная экзотермическая реакция. Термические эффекты действующих веществ и разработанных суппозиториев имеют подобный характер, что является непрямым свидетельством отсутствия химического взаимодействия между компонентами в составе препарата.
Проведенные исследования были учтены при разработке технологии изготовления суппозиториев и дают возможность утверждать, что сухие экстракты корня крапивы и семян тыквы являются термолабильными веществами и температура их введения в состав основы не должна превышать 49 и 62 °С соответственно. Сухой экстракт плодов пальмы сабаль является более термостабильным веществом.
Терапевтическая эффективность, качество и стабильность препарата находятся в прямой зависимости от технологии его изготовления. Поэтому при создании новых лекарственных препаратов разработке технологии уделяют особенное внимание. К основным стадиям получения суппозиториев, согласно требованиям GMP, принадлежат: приготовление суппозиторной основы, введения в ее состав действующих веществ, гомогенизация, розлив суппозиторной массы в формы, маркировка, упаковка и отгрузка.
С целью определения оптимального температурного режима ведения
технологического процесса производства были исследованы реологические свойства суппозиториев с растительными экстрактами. На рис. 5 приведена зависимость структурной вязкости суппозиторной основы от температуры.

Рис. 1. Дериватограмма сухого экстракта семян тыквы

Рис. 2. Дериватограмма сухого экстракта корня крапивы

Рис. 3. Дериватограмма сухого экстракта плодов пальмы сабаль

Рис. 4. Дериватограмма суппозиториев с растительными экстрактами
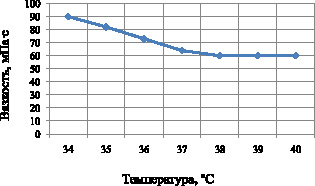
Рис. 5. Зависимость структурной вязкости суппозиторной основы от температуры
Как видно из рисунка, температура плавления твердого жира составляет 34 °С (значение вязкости 90 МПа∙с). При повышении температуры до 37 °С показатели вязкости уменьшаются до значения 64 МПа·с и остаются практически неизменными при дальнейшем нагревании.
Полученные результаты изучения зависимости структурной вязкости суппозиторной массы от температуры (рис. 6) показали, что температура плавления разработанных суппозиториев составляет 32 °С. При нагревании суппозиторной массы от 32 до 35 °С значение структурной вязкости находится в пределах от 1630 до 400 МПа∙с. При дальнейшем нагревании значения вязкости практически не изменяются (325 МПа∙с). Как видно из рисунка, введение действующих веществ значительно влияет на структурную вязкость. Снижение показателей вязкости суппозиторной массы по сравнению с основой обусловлено наличием в ее составе растительных экстрактов.
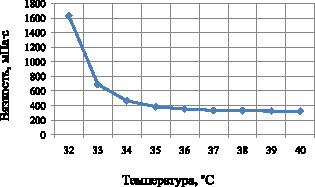
Рис. 6. Зависимость структурной вязкости суппозиторной массы от температуры
Полученные результаты позволяют нам выбрать оптимальный температурный режим изготовления суппозиториев – 35 °С; с технологической точки зрения необоснованное повышение температуры является нецелесообразным и может увеличить затраты на производство препарата.
Выводы
1. Проведен термогравиметрический анализ действующих компонентов новых суппозиториев для лечения заболеваний предстательной железы, по результатам которого установлено, что термические эффекты действующих веществ и разработанных суппозиториев имеют подобный характер, который является непрямым свидетельством отсутствия химического взаимодействия между компонентами в составе препарата.
2. Проведены исследования реологических характеристик суппозиторной массы и основы разработанных суппозиториев.
3. Определение зависимости структурно-механических показателей основы и суппозиторной массы от температуры позволило избрать оптимальный температурный режим ведения технологического процесса получения суппозиториев.
Рецензенты:Ярных Т.Г., д.фарм.н., зав. кафедрой технологии лекарств Национального фармацевтического университета, г. Харьков;
Тихонов А.И., д.фарм.н., профессор кафедры косметологии и аромологии Национального фармацевтического университета, академик УАН, г. Харьков.
Работа поступила в редакцию 31.01.2014.



