В последние годы в дополнение к кардиальной, кардиоренальной, гемодинамической и нейрогуморальной концепциям прогрессирования хронической сердечной недостаточности (ХСН) получила развитие теория иммунной активации [2]. В настоящее время иммунная теория патогенеза ХСН привлекает к себе все большее число сторонников [3]. Хорошо известно, что иммунная система организма отвечает не только при инфекционных агрессиях, но реагирует также на любое стрессовое воздействие, в том числе – на ишемию, гемодинамическую перегрузку, интоксикацию, то есть на те воздействия, которые способствуют возникновению и прогрессированию ХСН [6].
К иммунологическим маркерам, клиническое значение которых в последние годы является предметом наиболее интенсивных исследований в кардиологии, относятся белки острой фазы воспаления – провоспалительные цитокины, такие как фактор некроза опухоли-a, интерлейкины 1,6 и 8 [4]. Факт патогенетической взаимосвязи ХСН и повышенной экспрессии провоспалительных цитокинов в настоящее время экспериментально доказан [7]. Исследователи последних лет отводят экспрессии провоспалительных цитокинов не подчиненную роль, а ставят ее в ряд первопричин развития и прогрессирования ХСН [5]. Однако в настоящее время отсутствуют сведения и модели о прогностическом значении цитокинов в отношении определения риска прогрессирования ХСН. В связи с вышеизложенным целью работы явилась разработка прогностического математического инструментария для определения вероятности прогрессирования ХСН в зависимости от цитокинового статуса организма и выраженности системного воспаления.
Материалы и методы исследования
В клиническое исследование было включено 78 пациентов с ХСН II–IV ФК NYHA, в том числе 65 (83,3 %) мужчин и 13 (16,7 %) женщин. Средний возраст больных, включенных в исследование, составил 60,2 ± 9,9 лет. Все больные ранее перенесли острый крупноочаговый инфаркт миокарда (ОИМ); повторный ОИМ наблюдался у 9 (11,5 %) больных.
При оценке степени тяжести ХСН у 33 (42,3 %) больных выявлен II ФК, 30 (38,5 %) – III ФК и у 15 (19,2 %) – IV ФК. Длительность течения ХСН у включенных в исследование больных составила в среднем 3,2 ± 0,7 года.
Включенные в исследование пациенты были разделены на две группы в зависимости от тяжести ХСН. Больные со II ФК ХСН были объединены в 1 группу (n = 33), а с III–IV ФК ХСН – во 2 группу (n = 45). В 1 группе было 28 мужчин и 5 женщин, во 2 группе – 37 мужчин и 8 женщин. Контрольную группу составили 15 человек в возрасте от 55 до 63 лет (средний возраст 62,3 ± 7,6 лет) без признаков ИБС, артериальной гипертензии и ИБС.
Методом иммуноферментного анализа определяли содержание в плазме крови про- и противовоспалительных цитокинов: интерлейкинов (ИЛ) 1β, ИЛ-6 и ИЛ-8, рецепторного антагониста интерлейкина 1β (раИЛ-1β), γ-интерферона (γ-ИФ), фактора некроза опухолей-α (ФНО-α) с помощью тест-систем Вектор-Бест (Россия). При выполнении иммуноферментного анализа использовали термошейкер ST3 (Латвия) и аппарат для промывания планшетов Elisa Washer Human (США), оценку полученных результатов проводили на фотометре Multilabel Counter 1420 Victor (Финляндия).
Статистическую обработку результатов проводили с использованием компьютерной программы STATISTICA 7.0 (StatSoft, США). Для разработки математической модели использовали регрессионный анализ (логистическая регрессия), ROC (Receiver Operator Characteristic) – анализ. Модель настроена с учетом ошибок I и II рода в соотношении 50/50, доверительного интервала 95 %.
Результаты исследования и их обсуждение
Исходное содержание провоспалительных цитокинов у больных ХСН представлено в табл. 1.
Таблица 1
Содержание провоспалительных цитокинов в плазме крови у больных ХСН
|
Показатель |
1-я группа (n = 33) |
2-я группа (n = 45) |
В целом по больным (n = 78) |
Контрольная группа (n = 32) |
Р |
|
1 |
2 |
3 |
4 |
||
|
ИЛ-1β, пг/мл |
0,73 ± 0,075 |
1,35 ± 0,13 |
1,04 ± 0,09 |
1,64 ± 0,09 |
1–4 p < 0,05 2–4 p < 0,05 3–4 p < 0,05 1–2 p < 0,05 |
|
ИЛ-6, пг/мл |
2,08 ± 0,22 |
3,7 ± 0,49 |
2,79 ± 0,35 |
1,66 ± 0,05 |
1–4 p > 0,05 2–4 p < 0,05 3–4 p < 0,05 1–2 p < 0,05 |
|
ИЛ-8, пг/мл |
3,58 ± 0,37 |
7,44 ± 1,42 |
5,26 ± 0,82 |
30,4 ± 0,73 |
1–4 p < 0,001 2–4 p < 0,001 3–4 p < 0,001 1–2 p < 0,05 |
|
ФНО-α, пг/мл |
4,48 ± 0,83 |
9,06 ± 1,46 |
6,52 ± 0,82 |
0,57 ± 0,02 |
1–4 p < 0,001 2–4 p < 0,001 3–4 p < 0,001 1–2 p < 0,001 |
|
раИЛ-1β, пг/мл |
1083,37 ± 202,96 |
1097,26 ± 189,83 |
1089,4 ± 182,49 |
518,2 ± 2,78 |
1–4 p < 0,001 2–4 p < 0,001 3–4 p < 0,001 1–2 p > 0,05 |
|
ИФ-γ, пг/мл |
66,33 ± 9,29 |
69,2 ± 9,25 |
67,58 ± 8,58 |
2,1 ± 0,08 |
1–4 p < 0,001 2–4 p < 0,001 3–4 p < 0,001 1–2 p > 0,05 |
Анализ представленной информации позволил выявить у больных ХСН многократное возрастание содержания в крови ФНО-α: в 7,86 раз (p < 0,001) в 1 группе и в 15,9 раз (p < 0,05) во 2 группе. В целом по больным по сравнению с контрольной группой уровень ФНО-α в крови возрастал в 11,4 раз (p < 0,001). Относительно других провоспалительных цитокинов у больных ХСН двух групп выявлено повышение по сравнению с нормальным уровнем концентрации ИЛ-6. Содержание в крови ИЛ-1β и ИЛ-8 было сниженным в двух группах обследуемых.
У больных ХСН практически в 2 раза был повышен уровень рецепторного антагониста интерлейкина-1β по сравнению с контролем. Кроме того, в обеих группах наблюдалось многократное превышение концентрации интерферона-γ.
Таким образом, развитие ХСН сопровождается увеличением провоспалительных цитокинов в плазме крови. При этом повышение содержания противовоспалительных цитокинов можно считать как адаптивное, ограничивающее воспаление.
Для характеристики влияния параметров цитокинового статуса на величину фракции выброса (ФВ) как интегрального показателя систолической функции сердца у больных ХСН рассчитывали стандартный коэффициент регрессии b и коэффициент детерминации (табл. 2).
Таблица 2
Характеристика влияния параметров цитокинового статуса на величину фракции выброса у больных ХСН
|
Показатели |
Стандартный коэффициент регрессии b |
Коэффициент детерминации |
t |
p |
|
ИЛ-1b |
–0,92 |
0,48 |
0,75 |
0,045 |
|
раИЛ-1b |
1,27 |
0,54 |
36,95 |
0,0000001 |
|
ИЛ-6 |
–1,15 |
0,59 |
31,67 |
0,0000001 |
|
ИЛ-8 |
–0,34 |
0,17 |
1,53 |
0,21 |
|
ИФ-γ |
0,83 |
0,89 |
11,95 |
0,0000001 |
|
ФНО-α |
–0,08 |
0,88 |
11,24 |
0,0000001 |
Показатель стандартизированного коэффициента регрессии или b-коэффициент определял меру влияния вариабельности фактора на изменение ФВ при условии, что все другие показатели не изменяются. Коэффициент детерминации отражал вклад показателя цитокинового профиля в изменение ФВ. Анализ данных табл. 3 показал, что для снижения сократительной активности миокарда у больных ХСН из показателей цитокинового профиля значимую роль оказывали изменения концентрации интерферона-g, ФНО-a, ИЛ-6, ИЛ-1b и рецепторного антагониста к ИЛ-1b.
Механизмы, лежащие в основе цитокин-обусловленного повреждения миокарда и нарушения его сократительной функции, многообразны. Основной механизм связан с цитокинами и оксидом азота (рис. 1). Так, под влиянием ФНО-α, ИЛ-1β и ИЛ-6 происходит увеличение экспрессии индуцируемой формы фермента синтетазы оксида азота в кардиомиоцитах и эндотелиоцитах микрососудистого русла миокарда и гладкомышечных клетках сосудистой стенки [1]. В частности, ФНО-α увеличивает образование тетрагидробиоптерина, необходимого для активации синтетазы оксида азота. Повышение экспрессии индуцируемой формы синтетазы оксида азота приводит к повышению активности этого фермента и значительному увеличению синтеза оксида азота в кардиомиоцитах [7]. Цитокин-индуцированная гиперпродукция оксида азота оказывает непосредственное токсическое и повреждающее влияние на миокард, снижает его сократительную способность, активирует синтез соединительной ткани в миокарде и участвует в ремоделировании миокарда [4]. Кроме того, провоспалительные цитокины способствуют увеличению экспрессии в кардиомиоцитах остеопонтина, являющегося фосфопротеином внеклеточного матрикса, что также ведет к увеличению образования оксида азота в миокарде [3]. Повышенная продукция оксида азота активирует растворимую гуанилатциклазу, что увеличивает образование циклического гуанозинмонофосфата. Последний снижает сократительную функцию миокарда за счет уменьшения концентрации ионов кальция в цитоплазме кардиомиоцитов [1]. Важно отметить, что приведенные факты отрицательного кардиотропного эффекта касаются только оксида азота, выработанного самими кардиомиоцитами, а не эндотелиоцитами коронарного русла. Экспрессия цитокин-зависимой индуцируемой синтетазы оксида азота в кардиомиоцитах повышается в еще большей степени под влиянием катехоламинов, ангиотензина-II, вазо прессина, эндотелина [2].
Нами были получены математические выражения, описывающие зависимость между вероятностью риска прогрессирования ХСН (в долях единицы) и иммунологическими показателями, что отражено в табл. 3.
На рис. 2 представлен график логит аппроксимации зависимости риска прогрессирования ХСН одновременно от уровня двух провоспалительных цитокинов.
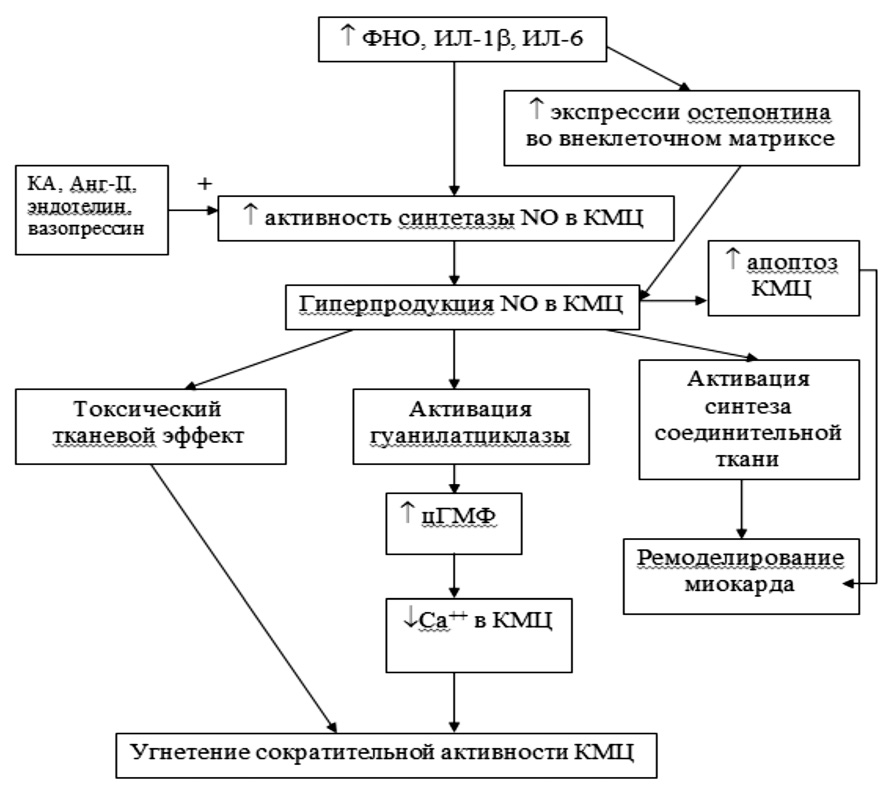
Рис. 1. Механизм цитокин-зависимого повреждения миокарда у больных ХСН. Примечание: NO – оксид азота, КМЦ – кардиомиоциты, КА – катехоламины, Анг-II – ангиотензин-II, ИЛ – интерлейкины, ФНО – фактор некроза опухоли, цГМФ – циклический гуанозинмонофосфат
Таблица 3
Уравнения математической аппроксимации между вероятностью риска прогрессирования ХСН (у) и иммунологическими показателями (х)
|
Фактор (х) |
Уравнения экспоненциального роста величины риска прогрессирования ХСН (у) |
χ2 |
р |
|
ИЛ-1β |
y = exp(–1,9107 + (1,94174)x)/(1 + exp(–1,9107 + (1,94174)*x)) |
9,78 |
< 0,001 |
|
ИЛ-6 |
y = exp(–,54924 + (,19427)x)/(1 + exp(–,54924 + (,19427)x)) |
6,25 |
0,027 |
|
ИФ-γ |
y = exp(–,94572 + (,016228)x)/(1 + exp(–,94572 + (,016228)x)) |
4,95 |
0,001 |
|
ФНО-α |
y = exp(–,98277 + (,192523)x)/(1 + exp(–,98277 + (,192523)x)) |
11,69 |
< 0,001 |
Математическое выражение зависимости между тремя величинами представлено в заголовке графика. Используя полученное уравнение, было установлено, что при уровне ИЛ-1β 1, 1,5 и 2 пг/мл и концентрации ФНО-a 5, 8 и 10 пг/мл вероятность прогрессирования ХСН составляет соответственно 58; 83 и 94 %.
Таким образом, увеличение ФК ХСН происходит сопряженно с повышением концентрации провоспалительных факторов крови.
Выводы
1. У больных ХСН выраженность кардиодепрессивного эффекта среди цитокинов наибольшая для ФНО-a, рецепторного антагониста к ИЛ-1b, интерферона-g и ИЛ-1b.
2. Сопряжение между увеличением ФК ХСН и концентрацией провоспалительных цитокинов в крови математически аппроксимируется с помощью логит-преобразования и может быть использовано для расчета риска прогрессирования ХСН.
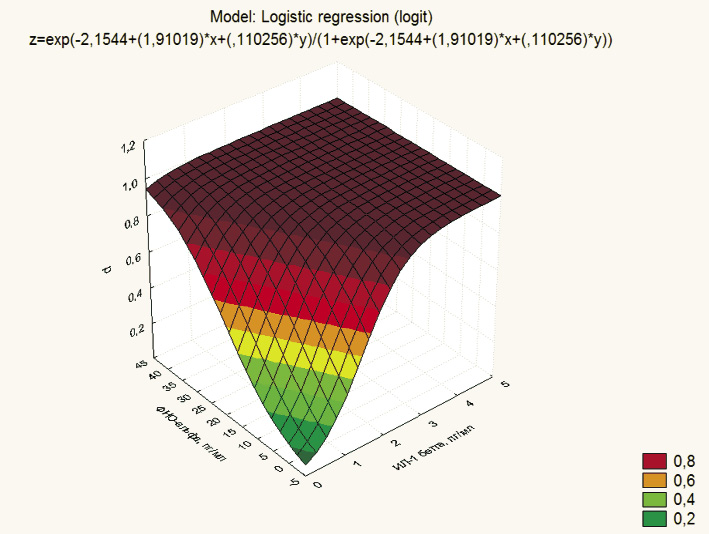
Рис. 2. График логит-аппроксимации зависимости риска прогрессирования ХСН (z) от уровня ИЛ-1β (х) и ФНО-a (y)
Рецензенты:Харсеева Г.Г., д.м.н., профессор, заведующая кафедрой микробиологии и вирусологии № 2, ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, г. Ростов-на-Дону;
Воробьев Б.И., д.м.н., профессор, заслуженный деятель науки РФ, профессор кафедры внутренних болезней № 2, ГБОУ ВПО «Ростовский государственный медицинский университет» Минздрава России, г. Ростов-на-Дону.
Работа поступила в редакцию 18.03.2014.



