В настоящее время особую значимость приобретают лекарственные средства растительного происхождения, применяемые для профилактики и лечения различных заболеваний [4, 6, 9]. Преимущество растительных лекарственных средств по сравнению с синтетическими препаратами заключается в мягкости их терапевтического действия наряду с отсутствием выраженных побочных эффектов. В этом отношении особый интерес представляют фенольные соединения лекарственных растений, которые являются ценным источником адаптогенных, нейротропных, иммуномодулирующих, противовирусных, антимикробных, противовоспалительных, гепатопротекторных, желчегонных и антиоксидантных лекарственных средств [1–6]. В последнее время среди фенольных соединений в центре внимания исследователей находятся фенилпропаноиды и флавоноиды [1, 2, 5–8, 11–14], однако в настоящее время на фармацевтическом рынке РФ доминируют дорогостоящие зарубежные препараты. Особенно неблагоприятна ситуация в номенклатуре антидепрессантных, ноотропных и анксиолитических растительных препаратов, которые практически все являются зарубежными [4, 6].
На основе изучения физико-химических, спектральных свойств ранее была обоснована необходимость введения в фармакогнозию фенилпропаноидов как самостоятельного класса биологически активных соединений (БАС), что нашло отражение в учебнике «Фармакогнозия» [3]. К фенилпропаноидам отнесены такие лекарственные растения, как родиола розовая, эхинацея пурпурная, элеутерококк колючий, сирень обыкновенная, расторопша пятнистая, лимонник китайский, лопух большой, омела белая [2, 3]. Фенилпропаноиды являются биогенетическим предшественником флавоноидов – одного из самых бурно развивающихся классов БАС, обладающих широким спектром фармакологической активности [2, 7]. За последние 10–15 лет число фармакопейных растений, содержащих флавоноиды в качестве ведущей группы БАС, возросло с 11 до 30 видов, среди которых уникальным является гинкго двулопастный как источник ноотропных лекарственных средств. Кроме того, в 25 лекарственных растениях флавоноиды выступают в роли 2-й или 3-й групп действующих веществ, причем в этом случае они, как правило, не только обусловливают фармакологический эффект, но и являются критерием качества сырья или лекарственной субстанцией [4, 7]. С точки зрения химической классификации нами критически пересмотрено положение некоторых лекарственных растений, например родиолы розовой, элеутерококка колючего, расторопши пятнистой (фенилпропаноиды), зверобоя продырявленного (флавоноиды) [3, 4].
В этой связи актуальными являются исследования по обоснованию целесообразности создания импортозамещающих тонизирующих, адаптогенных, антидепрессантных, ноотропных, анксиолитических и седативных растительных препаратов. В этом отношении особый интерес представляют лекарственные растения, содержащие флавоноиды и фенилпропаноиды [1, 2, 7, 8, 11–14].
Цель исследования – научное обоснование целесообразности создания и внедрения импортозамещающих нейротропных лекарственных средств на основе растительного сырья, содержащего флавоноиды и фенилпропаноиды.
Материал и методы исследования
В качестве объектов использованы корневища и корни родиолы розовой (Rhodiola rosea L.), кора сирени обыкновенной (Syringa vulgaris L.), корневища и корни элеутерококка колючего [Eleutherococcus senticosus (Rupr. et Maxim.) Maxim.], семена и плоды лимонника китайского (Schizandra chinensis Baill.), трава мелиссы лекарственной (Melissa officinalis L.), цветки лаванды колосовой (Lavandula spica L.), листья гинкго двулопастного (Ginkgo biloba L.), трава зверобоя продырявленного (Hypericum perforatum L.) и зверобоя пятнистого (Hypericum maculatum Grantz.), а также фенилпропаноиды и флавоноиды, выделенные из исследуемого лекарственного растительного сырья.
В работе использованы тонкослойная хроматография (ТСХ), высокоэффективная жидкостная хроматография (ВЭЖХ), спектрофотометрия, 1Н-ЯМР-спектроскопия, масс-спектрометрия, различные химические превращения. 1Н-ЯМР-спектры получали на приборах «Bruker AM 300» (300 МГц), масс-спектры снимали на масс-спектрометре «Kratos MS-30», регистрацию УФ-спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena). Воздушно-сухое растительное сырье подвергали исчерпывающему экстрагированию 70 % спиртом этиловым, полученные водно-спиртовые экстракты упаривали под вакуумом до густого остатка и далее подвергали хроматографическому разделению на силикагеле L 40/100. Контроль за разделением веществ осуществляли с помощью ТСХ-анализа на пластинках «Сорбфил ПТСХ-АФ-А-УФ» в системах хлороформ-этанол (9:1), хлороформ-этанол-вода (26:16:3), а также н-бутанол-ледяная уксусная кислота-вода (4:1:2). Антидепрессантную активность оценивали с использованием теста «Отчаяние», оценку ноотропной активности проводили с помощью теста «Т-образный лабиринт» и теста «Открытое поле», анксиолитическую активность определяли методом «Приподнятый крестообразный лабиринт» и в условиях методики «конфликтная ситуация», психостимулирующие свойства препаратов выявляли с помощью теста на снотворную активность («Тиопеталовый сон»), адаптогенное действие изучали с использованием теста принудительного плавания [10].
Результаты исследования и их обсуждение
В результате изучения химического состава целого ряда лекарственных растений выделены и охарактеризованы с использованием УФ-, ЯМР-спектроскопии, масс-спектрометрии, ТСХ и ВЭЖХ, различных химических превращений фенилпропаноиды (1–6) и флавоноиды (7–10), представляющие интерес с точки зрения химической стандартизации сырья и препаратов соответствующих лекарственных растений, а также проявления нейротропной активности.
В результате проведенных исследований предложены новые подходы к химической стандартизации сырья лекарственных растений с использованием стандартных образцов розавина (1), триандрина (2), сирингина (3), лавандозида (4), розмариновой кислоты (5), гамма-схизандрина (6), гинкгетина (7), 3,811-бисапигенина (8), гиперозида (9), никотифлорина (10).
Изучены зависимости спектральных и фармакологических свойств ряда фенилпропаноидов и флавоноидов от их химической структуры. На основе изучения физико-химических, химических, спектральных и фармакологических свойств флавоноидов и фенилпропаноидов обоснована целесообразность применения целого ряда импортозамещающих лекарственных средств.
Фенилпропаноиды лекарственных растений
|
|
|
|
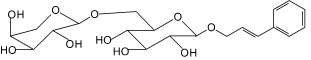
Розавин (1): родиола розовая |
Триандрин (2): родиола розовая (биомасса) |
|
|
|
|
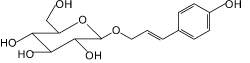
Сирингин, или элеутерозид В (3): элеутерококк колючий, сирень обыкновенная |
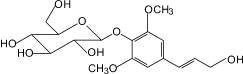
Лавандозид (4): лаванда колосовая |
|
|
|
|
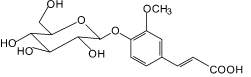
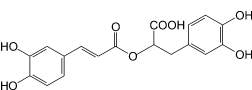
Розмариновая кислота (5): |
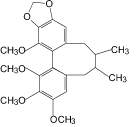
Гамма-схизандрин (6): лимонник китайский |
Флавоноиды лекарственных растений
|
|
|
|
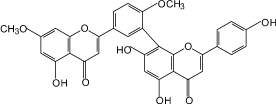
Гинкгетин (7): гинкго двулопастный |
3,811-Бисапигенин (8): зверобой продырявленный |
|
|
|
|
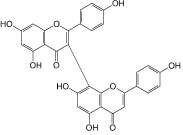
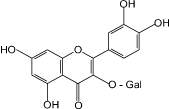
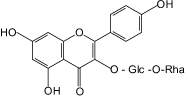
Гиперозид (9): зверобой продырявленный, |
Никотифлорин (10): гинкго двулопастный |
Особого внимания заслуживают нейротропные свойства флавоноидов, которые стали привлекать исследователей сравнительно недавно [5–7]. Среди фармакопейных растений, содержащих флавоноиды, в качестве источника нейротропных лекарственных препаратов применяются два вида – зверобой продырявленный и гинкго двулопастный [4, 5, 7]. При изучении флавоноидов листьев гинкго двулопастного выявлено, что вклад в ноотропную активность вносит гинкгетин, являющийся одним из характерных и диагностических компонентов сырья данного растения [3, 6, 7]. Впервые обнаружена анксиолитическая активность для лекарственного препарата «Гинкго двулопастного настойка», при этом показана значимость всего флавоноидного комплекса листьев гинкго двулопастного для проявления наиболее полного спектра нейротропной активности. Определено, что антидепрессантный эффект настойки зверобоя пятнистого более выражен по сравнению с таковым соответствующего препарата зверобоя продырявленного. При этом доказано, что среди флавоноидов травы зверобоя основной вклад в проявление антидепрессантного эффекта вносят 3,811-бисапигенин (8) и гиперозид (9).
Из цветков лаванды колосовой выделено новое природное соединение – лавандозид (4), обладающий седативной активностью, что свидетельствует о перспективности создания импортозамещающих нейротропных препаратов на основе сырья данного растения. Установлено, что перспективным источником анксиолитиков является трава мелиссы лекарственной, причем ключевую роль в проявлении анксиолитической активности играет розмариновая кислота (5). Показано, что наиболее перспективными в плане создания тонизирующих и адаптогенных средств являются растения, содержащие производные коричных спиртов (родиола розовая, сирень обыкновенная, элеутерококк колючий и др.), причем для экстракта элеутерококка жидкого отмечен также антидепрессантный эффект. Из выделенных веществ наибольшую антидепрессантную эффективность проявили розавин (1), триандрин (2), сирингин (3) и гиперозид (9). Выраженная ноотропная активность обнаружена для препаратов, разработанных на основе корневищ родиолы розовой, причем в этом отношении наибольшего внимания заслуживает доминирующий фенилпропаноид родиолы розовой – розавин (1).
Таким образом, лекарственные растения, содержащие флавоноиды и фенилпропанооиды, являются перспективным источником тонизирующих, адаптогенных, антидепрессантных, ноотропных, анксиолитических и седативных лекарственных средств.
Выводы
Результаты проведенных исследований позволили создать методологическую основу создания импортозамещающих тонизирующих, адаптогенных, антидепрессантных, ноотропных, анксиолитических и седативных лекарственных средств на основе сырья фармакопейных растений, содержащих флавоноиды и фенилпропаноиды.
Рецензенты:
Первушкин С.В., д.фарм.н., профессор, заведующий кафедрой фармацевтической технологии, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара;
Дубищев А.В., д.м.н., профессор, зав. кафедрой фармакологии им. заслуженного деятеля науки РФ, профессора А.А. Лебедева, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара.
Работа поступила в редакцию 23.04.2014.