Широкое распространение наркомании делает актуальными исследования нейробиологических основ формирования наркотической зависимости и поиска новых методов и подходов к ее лечению. В настоящее время экспериментальные работы по изучению эффектов вызывающих зависимость препаратов проводятся как in vivo, на различных моделях аддикции на животных, так и in vitro, на первичных культурах нервных клеток и клеточных линиях.
Культуры, являющиеся относительно однородными клеточными популяциями, предоставляют широкие возможности для изучения молекулярных механизмов действия наркотических веществ и первичного скрининга протекторных соединений, но не позволяют исследовать функционирование нейронных ансамблей и влияние взаимодействий между различными типами клеток нервной системы. Эти ограничения могут быть преодолены использованием органотипических культур нервной ткани.
Особенностью органотипических культур нервной ткани, отличающей их от первичных культур нейронов и клеточных линий, является сохранение характерной для данного отдела мозга цитоархитектуры и внутренних межнейронных связей. Это позволяет в условиях in vitro исследовать клеточные и молекулярные механизмы патологических состояний, функциональные параметры синаптической пластичности, делает их удобной моделью для скрининга биологически активных соединений.
Наиболее широко используется органотипическая культура гиппокампа (ОКГ). Mорфологическое и функциональное становление системы внутренних связей гиппокампа происходит постнатально, срезы гиппокампа, взятые у животных в раннем постнатальном периоде, можно культивировать в течение длительного срока. При этом сохраняется расположение клеточных слоев, а формирование и функциональное созревание специфических синаптических связей происходит in vitro. Таким образом, культура гиппокампа представляет собой удобную модель для изучения морфологических и функциональных характеристик как развивающейся, так и зрелой нервной ткани. ОКГ были использованы для изучения эффектов гипоксии, гипогликемии, комбинации их при моделировании ишемии, окислительного стресса, повреждающего действия возбуждающих аминокислот, нейротоксинов, органических растворителей и этанола [3, 7, 11].
В представленной работе мы анализировали влияние кратковременного и длительного культивирования ОКГ с морфином и вызванных этим изменений синаптической пластичности, сопоставляя эти данные с ранее полученными на животных при формировании у них хронической опиатной зависимости [1].
Материалы и методы исследования
Культивирование: Крыс в возрасте 7–8 дней получали из Лаборатории экспериментальных животных Института цитологии и генетики СО РАН, все экспериментальные процедуры на животных были одобрены комитетом по биомедицинской этике ФГБУ «НИИМББ» СО РАМН и проводились в соответствии с Принципами надлежащей лабораторной практики (Национальный стандарт РФ ГОСТ Р 53434-2009) и согласно «Директиве 2010/63/EU Европейского парламента и совета Европейского союза по охране животных, используемых в научных целях». Получение и культивирование срезов гиппокампа проводили, как описано ранее [12]. Коротко, поперечные срезы гиппокампа (400 мкм) помещали на покрытые коллагеном стекла, оставляли на 30 мин. во влажной камере (чашки Петри с «пьедесталами») при 36 °С в CO2-инкубаторе для прикрепления, а затем добавляли среду, содержащую 25 % раствора Хэнкса, 10 % эмбриональной телячьей сыворотки, 65 % среды Игла в модификации Дульбекко и добавки инсулина (0,2–0,3 ед./мл), L-глутамина (0,29 г/л), глюкозы (6,5 мг/мл). Культивирование срезов вели в СО2-инкубаторе при 5 % СО2, 90 % влажности, 36 °С. Смену среды проводили раз в два дня. На второй день культивирования в среду на 24 часа добавляли антимитотические препараты (5-Fluoro-2-deoxyuridine, cytosine-b-d-arabinofuranoside, uridine, Sigma, США) в конечной концентрации 10–6–10–7 М для подавления размножения макрофагов и фибробластов, нарушающего органотипию среза.
Культивирование контрольных культур вели в стандартной культуральной среде. Для исследования длительного воздействия морфина (конечная концентрация 10 μМ) морфин добавляли к культуральной среде с 4-го дня культивирования, при изучении кратковременного (48 ч) воздействия морфин вносили на 10–11 дни in vitro. Состояние органотипических культур регулярно оценивали визуально.
Морфологический анализ и оценка выживания клеток. Для оценки морфологических характеристик использовали общепринятые методы гистологического анализа. На 5, 10, 14, 21 дни культивирования эксплантаты фиксировали 10 % нейтральным формалином и затем окрашивали крезиловым фиолетовым или импрегнировали серебром по методу Бодиана с последующим контрастированием хлорным золотом. Для оценки количества погибших клеток препараты окрашивали иодидом пропидия (3 µг/мл среды, 1 час в СО2-инкубаторе), промывали раствором Хэнкса, фиксировали 4 % параформом (1 ч) и заключали в глицерин. Анализ полученных препаратов проводили на конфокальном микроскопе LSM 510 (Carl Zeiss).
Электрофизиологические эксперименты. Для выявления функциональных изменений, вызванных острым и хроническим действием морфина, регистрировали суммарный возбуждающий постсинаптический потенциал (ВПСП) мшистых волокон в ответ на тестирующие стимулы и оценивали параметры синаптической пластичности на модели длительной посттетанической потенциации (ДПТП). Ранее было показано [2], что ДПТП может быть вызвана в ОКГ крыс начиная с 7–9 дней культивирования, поэтому для экспериментов использовали ОКГ с 13 по 20 день in vitro.
Для проведения электрофизиологических экспериментов стекла с ориентированными эксплантатами помещали в проточную термостатированную камеру в среду следующего состава (в мМ): NaCl – 124; KCL – 4,9; KH2PO4 – 1,2; MgSO4 – 1,3; CaCl2 – 2,5; NaHCO3 – 25,6; D-глюкоза – 10; pH 7,5, аэрируемую карбогеном (95 % О2 – 5 % CО2). После 20-минутной инкубации стимулирующий электролитически заточенный биполярный вольфрамовый электрод помещали в область мшистых волокон, регистрирующий стеклянный электрод (сопротивление 2–5 МОм, заполнен 2,5 М NaCl) – в зоне начальных апикальных дендритов пирамидных нейронов области СА3. Тестирование проводили при помощи одиночных прямоугольных стимулов длительностью 200 мкс, наносимых не реже, чем через 5 мин. Вызванные потенциалы регистрировали при помощи 12-разрядного АЦП (Digidata, Molecular Devices) и обрабатывали, используя пакет программ pClamp-6 (Axon Instruments). Для выработки ДПТП амплитуду тестирующего стимула подбирали таким образом, чтобы величина ответа составляла около 50 % от максимальной. Тетанизацию проводили тремя последовательными пачками стимулов частотой 200 Гц, длительность каждой пачки импульсов 1 с, интервал между пачками 2 с. Через 10 мин процедуру тетанизации повторяли.
Регистрацию вызванных потенциалов вели не менее 60 мин после тетанизации, что позволяло сделать заключение о формировании или отсутствии ДПТП. Считали, что ДПТП формируется, если после второй тетанизации амплитуда сигнала увеличивалась более чем в 1,5 раза (или на 50 %), и оставалась таковой на протяжении всего времени наблюдения. Относительное изменение амплитуды суммарного ВПСП после тетанизации вычисляли по формуле
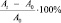 ,
,
где A0 – амплитуда ответа на тестовый стимул до тетанизации; At – соответствующая амплитуда после тетанизации.
Статистический анализ и обработку данных проводили с использованием пакетов программ Statistica 9 (StatSoft) и OriginPro 8.1 (OriginLab Corporation). Для оценки межгрупповых различий использовали однофакторный дисперсионный анализ (ANOVA). Оценку достоверности различий средних значений параметров проводили с использованием t-критерия Стьюдента и критерия Манна ‒ Уитни. Различия между группами считались достоверными при уровне значимости p < 0,05. Данные представлены в виде арифметического среднего и стандартной ошибки среднего (M ± SEM).
Результаты исследования и их обсуждение
Через сутки после посадки срезов и в течение всего последующего срока культивирования в контрольной и опытной (культивирование в присутствии 10 µМ морфина) группах культур наблюдали формирование типичной зоны роста, образующейся по периферии эксплантата за счет мигрирующих астроцитов и фибробластов, а также покидающих эксплантат отростков нейронов. Незначительная их часть покидает эксплантат по всей его границе, в то время как наибольшая часть нейритов выходит из эксплантата в зоне фимбрии и остатка энторинальной коры, то есть в тех областях, где в норме проходят выходящие из гиппокампа аксоны пирамидных нейронов области СА3 и СА1. В этой зоне в ходе культивирования можно наблюдать фасцикуляцию (образование пучков) аксонов. Постепенно фибробласты мигрируют к границам зоны роста, а нейриты, тела и отростки астроцитов, контактируя, образуют плотную сетевидную структуру.
Нарушений прикрепления к субстрату в опытной и контрольных группах срезов отмечено не было. Расположение основных клеточных слоев (слой гранулярных клеток зубчатой фасции и слой пирамидных нейронов Аммонова рога) также соответствовало таковому в срезах гиппокампа целого мозга.
Как можно увидеть на рис. 1, единичные погибшие клетки как в контрольных, так и в опытных ОКГ расположены по всей толще эксплантата и не ассоциированы с каким-либо из определенных полей. В опытных культурах можно было отметить несколько более интенсивное окрашивание мелких ядер в области зубчатой фасции, где расположена герминальная зона, содержащая недиффенцированные клетки-предшественники.
 а
а 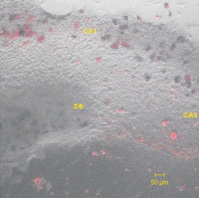 б
б
Рис. 1. Оценка жизнеспособности клеток в органотипической культуре гиппокампа с помощью окраски иодидом пропидия. 17 дней in vitro: а – культивирование в стандартной среде (контроль); б – культивирование в присутствии морфина (10 µМ). Длина волны возбуждения 535 нМ, излучения – 560 нМ
В ОКГ присутствуют крупные клетки-макрофаги, представляющие собой активированную микроглию. Активность их наиболее высока на ранних этапах культивирования, когда они участвуют в удалении материала, поврежденного при приготовлении срезов, а затем постепенно снижается. При использовании иодида пропидия клетки макрофагальной глии иногда захватывали окрашенный клеточный материал, в этом случае свечение было локализовано в цитоплазме, в то время как ядро оставалось темным. Мы не наблюдали достоверного изменения числа таких клеток в опытных ОКГ по сравнению с контрольными. Таким образом, длительное культивирование срезов гиппокампа крыс в среде, содержащей 10 µМ морфина, не влияло существенным образом на жизнеспособность клеток ОКГ.
Электрофизиология
Непосредственная аппликация морфина (10 µМ) на органотипическую культуру с последующей 20-минутной инкубацией не вызывает достоверных изменений амплитуды и латентности ВПСП мшистых волокон в ответ на тестовый стимул. В то же время под воздействием морфина амплитуда ВПСП через 60 мин после тетанизации достоверно выше, чем в контрольных культурах (рис. 2).
 а
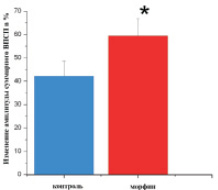
а 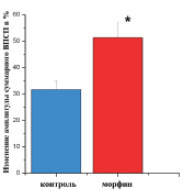 б
б
Рис. 2. а – изменение относительной амплитуды суммарного ВПСП мшистых волокон через 60 минут после тетанизации при 20-минутной инкубации после аппликации морфина на ОКГ. * – р < 0,05 (n = 7); б – изменение относительной амплитуды суммарного ВПСП мшистых волокон через 60 минут после тетанизации при 48-часовом культивировании в присутствии 10 µМ морфина на ОКГ. * – р < 0,05 (n = 8)
Кратковременное (48 час) культивирование в присутствии морфина также не изменяло базовых характеристик и вызывало фасилитацию ДПТП мшистых волокон.
При длительном культивировании в присутствии морфина (10 и более дней) было зарегистрировано достоверное увеличение амплитуды суммарного ВПСП мшистых волокон в ответ на тестовые стимулы (контроль – 3,4 ± 0,36 мВ, n = 11; опыт – 4,9 ± 0,47 мВ, n = 9; p = 0,019). При этом вероятность формирования ДПТП при использовании стандартной процедуры тетанизации значительно уменьшалась: если в контрольных культурах формирование ДПТП наблюдали в 85 % случаев, то в опытных – менее чем в 40 %.
Моделирование различных заболеваний мозга, таких как инсульт [3, 14], болезнь Альцгеймера [8], эпилепсия [6, 9] in vitro, на органотипической культуре гиппокампа, не только расширяет возможности исследования клеточно-молекулярных механизмов этих заболеваний, но и позволяет проводить тестирование широкого спектра нейропротекторных соединений.
Полученные нами данные свидетельствуют о том, что долговременное культивирование в присутствии морфина не влияет на жизнеспособность ОКГ, но приводит к модификации функциональных характеристик системы синаптических связей «гранулярные клетки зубчатой фасции – пирамидные нейроны области СА3» (мшистых волокон).
Исследования последних лет показали, что развитие наркотической зависимости обусловлено изменениями нейрональной и синаптической пластичности различных отделов мозга, а молекулярные механизмы этих изменений подобны тем, что происходят при обучении и запоминании [10, 15]. Наибольшее количество работ было выполнено на гиппокампе, структуре, непосредственно связанной с процессами обучения и памяти, с использованием ДПТП как экспериментальной модели синаптической пластичности. Полученные данные о параметрах ДПТП в гиппокампе животных с хронической зависимостью от морфина противоречивы, на различных системах синаптических связей показаны как фасилитация ДПТП, так и нарушения ее формирования [5, 13]. Эти противоречия не могут быть объяснены только использованием разных схем получения морфина животными, но связаны, вероятно, со стадийностью развития хронической зависимости. Ранее мы исследовали динамику изменений ДПТП мшистых волокон в ходе развития, на ранних и поздних стадиях сформированной хронической опиатной зависимости [1], что дает возможность сопоставления с данными, полученными в представленной работе. Так, аппликация морфина на нативную культуру вызывает фасилитацию ДПТП мшистых волокон, что согласуется с результатами, полученными на срезах гиппокампа нативных животных [4]. Кратковременная (48 час) инкубация ОКГ с морфином соответствует периоду развития и ранним стадиям зависимости у животных, а длительная – более поздним стадиям (в наших экспериментах – после 50 дня потребления наркотика), когда выявляется нарушение формирования ДПТП [1]. Таким образом, временная динамика изменений синаптической пластичности при инкубации ОКГ с морфином в целом соответствует динамике изменений в гиппокампе животных при развитии хронической зависимости от морфина. Полученные данные позволяют предполагать, что ОКГ может быть использована в качестве модели для изучения клеточно-молекулярных процессов, лежащих в основе развития наркотической зависимости.
Рецензенты:
Ратушняк А.С., д.б.н., зав. лабораторией «Биомедицинская информатика», ФГБУН «Конструкторско-технологический институт вычислительной техники» Сибирского отделения Российской академии наук, г. Новосибирск;
Гилинский М.А., д.б.н., зав. лабораторией регуляции адаптационных процессов, ФГБУН «Научно-исследовательский институт физиологии и фундаментальной медицины» Сибирского отделения Российской академии медицинских наук, г. Новосибирск.
Работа поступила в редакцию 15.05.2014.



