В настоящее время особенно актуальным является поиск новых типов катализаторов на основе природных материалов и отходов различных химических производств жидких продуктов из бурых углей Республики Казахстан. Применение таких каталитических систем позволит исключить использование дорогостоящего и дефицитного молибденового катализатора, который применяется в зарубежных технологиях, что в значительной степени позволит улучшить экологическую обстановку на производстве в целом [1, 2].
Процесс деструктивной гидрогенизации угля до последнего времени разрабатывался эмпирически. Далеко не всегда учитывались термодинамические и кинетические особенности процесса ожижения угля. Между тем научно обоснованный выбор катализаторов, условий проведения процесса гидрогенизации и переработки синтетической нефти в значительной мере может и должен исходить из учета как термодинамических характеристик исходных углей и самих реакций гидрогенизации, так и кинетических параметров процессов, реализуемых на практике. Такой подход может в принципе не только облегчить создание наиболее экономичных условий проведения процессов, но и помочь прогнозированию выбора исходных углей, катализаторов и регулированию маршрутов в зависимости от назначения целевых продуктов.
Цель исследования – установление кинетико-термодинамических характеристик процесса гидрогенизации Мамытского угля.
Материал и методы исследования
В качестве материала исследования для процесса получения синтетического жидкого продукта путем гидрогенизации был использован бурый уголь Мамытского месторождения со следующими физико-химическими характеристиками Wa – 3,03 %, Ас – 11,31 %, VГ – 34,82 %, Сdaf – 73,06 %, Нdaf – 4,71 %, Sd – 0,34 %, 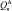 – 29,2 кДж/моль,
– 29,2 кДж/моль, 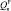 – 28,0 кДж/моль,
– 28,0 кДж/моль, 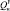 – 26,8 кДж/моль. Результаты определения элементного состава угля (С:Н = 15,5; 100Н:С = 6,45), согласно литературным данным свидетельствуют о том, что уголь пригоден для ожижения. В качестве пастообразователя (ПО) применялась тяжелая фракция нефти Каражанбас (ρ = 943,1 кг/м3, ηкин = 539 при 30 °С, Ммол = 384, С = 82,5 %, Н = 11,8 %, N = 0,9 %, S = 2,6 %, O = 2,2 %, коксуемость 7,2 %), выкипающая при температуре выше 773К, а также фракция > 623К, выделенная из продуктов ожижения исходного угля.
– 26,8 кДж/моль. Результаты определения элементного состава угля (С:Н = 15,5; 100Н:С = 6,45), согласно литературным данным свидетельствуют о том, что уголь пригоден для ожижения. В качестве пастообразователя (ПО) применялась тяжелая фракция нефти Каражанбас (ρ = 943,1 кг/м3, ηкин = 539 при 30 °С, Ммол = 384, С = 82,5 %, Н = 11,8 %, N = 0,9 %, S = 2,6 %, O = 2,2 %, коксуемость 7,2 %), выкипающая при температуре выше 773К, а также фракция > 623К, выделенная из продуктов ожижения исходного угля.
Эксперименты по ожижению угля проводили во вращающемся автоклаве объемом 0,25 дм3 при температуре 653–713 К, давлении до 4,0 МПа и времени изотермической выдержки 10–40 минут, а также на проточной установке высокого давления.
Результаты исследования и их обсуждение
Изучение кинетики и термодинамики процессов гидрогенизационной переработки угля осложняется взаимозависимостью самых разнообразных факторов, в том числе различиями составов и свойств используемого исходного сырья.
Сложность химического строения угля [3–6], многокомпонентность образующихся жидких продуктов обусловливает трудность интерпретации результатов и неопределенность расчета кинетических параметров. Число сложных реакций, происходящих в конденсированной фазе, и гетерогенных процессов таково, что описание кинетики каждой индивидуальной реакции невозможно. Поэтому при теоретическом анализе процесс гидрогенизации угля рассматривают как некоторую единую реакцию первого порядка и для ее описания используют некоторые усредненные кинетические уравнения зависимости скорости образования жидких и газообразных продуктов от температуры [7].
В работе исследована кинетика гидрогенизации угля с использованием метода равновесно-кинетического анализа (РКА).
Равновесно-кинетический анализ химических процессов является независимым аналогом известных равновесно-кинетических отображений химических систем и дополняет общий вероятностно-детерминированный подход к их рассмотрению. Можно конструировать модели РКА для самых различных процессов и представлять их в дифференциальной и интегральной формах. РКА может быть источником получения комплексной кинетико-термодинамической информации, а также единой программой обработки результатов эксперимента. Кроме того, равновесно-кинетический анализ позволяет количественно оценивать качество того или иного эксперимента.
Анализ литературных данных показывает, что сведения о кинетике гидрогенизации угля в основном представлены в среде водорода и катализаторов на основе молибдена и кобальта. Однако наши экспериментальные данные [8] показывают, что гидрирование происходит по механизму опосредованного катализа, т.е. не молекулярным водородом, а путем переноса водорода от молекул промежуточных углеводородных продуктов к ОМУ, а катализатор в основном восстанавливает утраченные Н-донорные свойства пастообразователя.
Поэтому в общей реакции процесса водород как отдельный компонент не учитывается, а схема записывается в виде
Уголь + ПО ↔ ЖП
или
Q(К) + R(Р) ↔ N(р).
Предположим, что фиксируемая скорость процесса лимитируется химической (кинетической) стадией и влияние обратной реакции по условиям эксперимента не исключается. Тогда суммарная скорость как разность скоростей прямой и обратной реакции при постоянной температуре, согласно закону действующих масс, будет равна
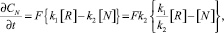 (1)
(1)
где F – площадь поверхности реагирования; k1 и k2 – константы скоростей прямой и обратной реакций; [R] и [N] – концентрации растворителя (пастообразователя) и продукта реакции; 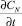 – суммарная скорость процесса.
– суммарная скорость процесса.
Если обозначить начальную концентрацию R как C0, а текущую концентрацию N – как CN, то
[R] = C0–CN,
а CN = C0–CR, где CR – текущая концентрация ПО. Выражение концентрационной константы равновесия реакции с учетом принятых обозначений можно записать как
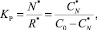 (2)
(2)
где звездочка относится к величинам равновесных концентраций.
При составлении феноменологической модели указанного процесса следует указать, что конденсированная фаза Q обладает однородными свойствами по всем направлениям, а фронт реакции равномерно перемещается в глубь каждой частицы по нормали к ее поверхности. Тогда для сферической частицы радиусом r0 поверхность реагирования будет уменьшаться в соответствии с возрастанием концентрации продукта реакции в растворе.
Общие научные концепции равновесно-кинетического анализа, основанные на разумном сочетании детерминированного с вероятностным подходом, позволяют решить задачу определения равновесной концентрации на основе рядового массива экспериментальных данных вероятностным методом с любой заданной степенью точности. Это достигается подбором такой величины 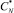 , которая соответствует максимуму коэффициента корреляции прямой с результатами эксперимента. То есть полученные расчетные данные сравниваются с экспериментальными по величине коэффициента корреляции.
, которая соответствует максимуму коэффициента корреляции прямой с результатами эксперимента. То есть полученные расчетные данные сравниваются с экспериментальными по величине коэффициента корреляции.
После определения коэффициента корреляции и его значимости расчеты повторяются при новом, более высоком значении равновесной концентрации и т.д. вплоть до начала уменьшения коэффициента корреляции. Найденная величина 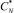 используется для дальнейших расчетов. После этого находятся k2, KP, а k1 вычисляют по формуле
используется для дальнейших расчетов. После этого находятся k2, KP, а k1 вычисляют по формуле
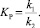 (3)
(3)
При использовании метода РКА были определены следующие кинетические и термодинамические параметры гидрогенизации угля Мамытского месторождения (табл. 1):
– Равновесная степень реагирования при различных температурах.
– Скорости прямой и обратной реакций.
– Константа равновесия каталитической гидрогенизации угля.
– Энергия активации прямой и обратной реакций.
– Свободная энергия Гиббса реакции.
– Тепловой эффект и энтропия процесса гидрогенизации Мамытского угля.
Таблица 1
Кинетические и термодинамические параметры процесса гидрогенизации угля Мамытского месторождения
|
Характеристики |
Значения характеристик при различных температурах |
|||
|
653 К |
673 К |
693 К |
713 К |
|
|
|
27,8 |
37,3 |
44,1 |
46,8 |
|
k1, мин–1 |
9,8∙10–3 |
1,07∙10–2 |
1,30∙10–2 |
1,38∙10–2 |
|
k2, мин–1 |
7,8∙10–3 |
3,6∙10–3 |
1,7∙10–3 |
1,08∙10–3 |
|
Kp |
1,26 |
2,94 |
7,54 |
12,74 |
|
|
42–55 |
|||
|
|
(–100)–(–119) |
|||
|
ΔG, кДж/моль |
–1,255 |
–6,036 |
–11,644 |
–15,090 |
|
ΔH, кДж/моль |
–152,9 |
|||
|
ΔS, Дж/мольК |
194–230 |
|||
Как видно из табл. 1, скорость прямой реакции с увеличением температуры растет, тогда как скорость обратной реакции с повышением температуры уменьшается.
Известно, что при низких температурах процесс деструктивной гидрогенизации лимитируется диффузией угольного вещества через границу раздела фаз. Сокольским Д.В. с сотрудниками было доказано, что процессы присоединения водорода в определенных условиях могут протекать в кинетической области. Экспериментально подобраны условия, при которых процесс протекает в кинетической области. Все кинетические измерения проводились при скорости перемешивания ≈ 420–430 кач./мин.
Таким образом, методом равновесно-кинетического анализа можно получить более подробную кинетико-термодинамическую информацию по сравнению с известными методами.
Основным недостатком равновесно-кинетического анализа является условная схема реакции. Конечно, в процессе каталитической гидрогенизации образуется несколько сотен индивидуальных соединений. Как уже говорилось выше, в этом и заключается сложность расчетов. Для полноты кинетической информации нами на основании исследований группового состава жидких продуктов (табл. 2) предложена следующая схема маршрута ожижения угля:
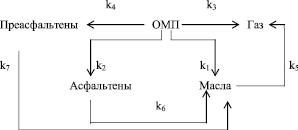
Таблица 2
Групповой состав продуктов, полученных при гидрогенизации угля Мамытского месторождения
|
Т, К |
t, мин |
ОМП, % |
Продукты, % |
|||
|
Асфальтены |
Преасфальтены |
Газ |
Масло + вода |
|||
|
653 |
5 |
60,8 |
0,94 |
1,02 |
3,92 |
33,32 |
|
10 |
58,6 |
0,99 |
1,08 |
4,35 |
34,98 |
|
|
15 |
55,0 |
1,08 |
1,22 |
5,35 |
37,35 |
|
|
30 |
50,6 |
1,23 |
1,43 |
6,18 |
40,56 |
|
|
45 |
49,2 |
1,47 |
1,57 |
6,86 |
40,90 |
|
|
60 |
48,8 |
1,39 |
1,46 |
7,15 |
41,20 |
|
|
90 |
48,0 |
1,25 |
1,35 |
8,04 |
41,36 |
|
|
673 |
5 |
52,9 |
1,41 |
1,55 |
6,50 |
37,64 |
|
10 |
46,6 |
1,71 |
1,87 |
8,06 |
41,76 |
|
|
15 |
35,7 |
2,18 |
2,38 |
9,64 |
50,10 |
|
|
30 |
31,8 |
2,45 |
2,66 |
11,05 |
52,04 |
|
|
45 |
27,9 |
2,74 |
3,03 |
11,82 |
54,51 |
|
|
60 |
27,0 |
2,64 |
2,95 |
12,07 |
55,34 |
|
|
90 |
24,3 |
2,48 |
2,76 |
14,30 |
56,16 |
|
|
693 |
5 |
47,7 |
1,94 |
2,25 |
7,53 |
40,58 |
|
10 |
36,6 |
2,68 |
3,25 |
9,87 |
47,90 |
|
|
15 |
30,1 |
3,15 |
4,40 |
11,74 |
50,61 |
|
|
30 |
23,5 |
3,83 |
5,66 |
13,46 |
53,55 |
|
|
45 |
13,7 |
4,49 |
6,90 |
16,05 |
58,86 |
|
|
60 |
13,4 |
4,47 |
6,86 |
16,51 |
58,76 |
|
|
90 |
12,3 |
4,29 |
5,97 |
19,45 |
57,99 |
|
|
713 |
5 |
33,8 |
2,71 |
3,38 |
10,66 |
49,45 |
|
10 |
25,9 |
3,85 |
5,11 |
13,56 |
51,58 |
|
|
15 |
18,6 |
4,80 |
6,92 |
16,44 |
53,24 |
|
|
30 |
13,5 |
5,54 |
8,39 |
19,46 |
53,11 |
|
|
45 |
8,3 |
6,51 |
12,10 |
22,19 |
50,90 |
|
|
60 |
7,0 |
6,45 |
12,04 |
25,33 |
49,18 |
|
|
90 |
6,5 |
5,89 |
11,72 |
28,20 |
47,69 |
|
Из прямолинейной зависимости в координатах lg С – t можно сделать вывод, что реакция гидрогенизации описывается уравнением первого порядка. Тогда, согласно предложенной схеме, процесс можно описать следующей системой дифференциальных уравнений:
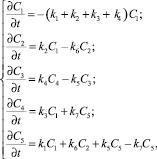 (4)
(4)
где C1 – концентрация ОМП; C2 – концентрация асфальтенов в жидком продукте; C3 – концентрация преасфальтенов в жидком продукте, С4 – концентрация газообразных продуктов; С5 – концентрация масел в жидком продукте; k1 – константа скорости реакции превращения ОМП в масла; k2 – константа скорости реакции превращения ОМП в асфальтены; k3 – константа скорости реакции превращения ОМП в газообразные продукты; k4 – константа скорости реакции превращения ОМП в преасфальтены; k5 – константа скорости реакции превращения масел в газообразные продукты; k6 – константа скорости реакции превращения асфальтенов в масла; k7 – константа скорости реакции превращения преасфальтенов в масла.
Используя программу «Поиск», по уравнениям на ЭВМ были рассчитаны все константы скорости по данной схеме. Результаты расчетов представлены в табл. 3.
Разработанная программа для расчетов констант скоростей позволяет рассчитывать кинетические зависимости при заданных начальных условиях и проводить автоматизированный подбор методом градиента оптимальных значений констант скоростей k1–k7. Оптимизация констант скоростей осуществлялась из условия минимума квадратов отклонений между экспериментальными и расчетными значениями массовых долей продуктов гидрогенизации угля.
Из анализа результатов констант скоростей, представленных в табл. 3, можно сделать вывод о том, что взаимосвязь констант скоростей и выхода продуктов гидрогенизации угля неоднозначна. Так, выход масел в основном обусловлен величиной константы скорости k1, а также k6 и k5, причем вероятность последних с увеличением температуры резко уменьшается. Из табл. 3 видно, что реакция крекинга жидкого продукта до газообразных резко увеличивается при температуре 713 К. Величины констант первых четырех стадий схемы с увеличением температуры повышаются. Самой быстрой стадией является стадия получения целевого продукта (k1). Суммарная константа процесса гидрогенизации угля kƩ увеличивается с повышением температуры.
Таблица 3
Кинетика процесса гидрогенизации Мамытского угля
|
Константа скорости, мин–1 |
Стадия процесса |
Температура гидрогенизации, К |
|||
|
653 |
673 |
693 |
713 |
||
|
k1 |
ОМП → масла |
1,556 |
2,501 |
3,049 |
4,600 |
|
k2 |
ОМП → асфальтены |
0,0691 |
0,1620 |
0,2370 |
0,4150 |
|
k3 |
ОМП → газ |
0,229 |
0,531 |
0,766 |
1,354 |
|
k4 |
ОМП → преасфальтены |
0,0779 |
0,1770 |
0,2910 |
0,5860 |
|
k5 |
масла → газ |
0,339∙10–4 |
0,507∙10–4 |
0,504∙10–4 |
0,107 |
|
k6 |
асфальтены → масла |
1,3870 |
1,2350 |
0,4200 |
0,0012 |
|
k7 |
преасфальтены → масла |
1,424 |
1,231 |
0,635∙10–3 |
0,721∙10–3 |
|
kƩ |
1,932 |
3,371 |
4,343 |
6,955 |
|
|
F |
2,55 |
1,88 |
1,63 |
1,39 |
|
F – критерий минимизации:
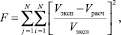 (5)
(5)
где N – число замеров в опытах; Vэксп, Vрасч – экспериментальные и расчетные значения содержания компонентов в гидрогенизате.
Таким образом, полученная нами кинетико-термодинамическая картина процесса гидрогенизации угля Мамытского месторождения позволяет не только приблизиться к знанию механизма процесса, но и дает возможность регулировать скорость и селективность процесса.
Выводы
Определенные в работе кинетические и термодинамические параметры гидрогенизации угля Мамытского месторождения (равновесная степень реагирования при различных температурах, скорости прямой и обратной реакций, константа равновесия каталитической гидрогенизации угля, свободная энергия Гиббса реакции, тепловой эффект и энтропия) использованы в технологических расчетах на углехимическом комплексе.
На основании группового состава полученных жидких продуктов предложена схема маршрута реакций процесса гидрогенизации угля Мамытского месторождения. Установлено, что самой быстрой стадией является стадия получения целевого продукта (масла).
Рецензенты:
Акбаева Д.Н., д.х.н., доцент, профессор кафедры физической химии, катализа и нефтехимии, Казахский национальный университет имени аль-Фараби Министерства образования и науки РК, г. Алматы;
Абилдин Т.С., д.х.н., профессор кафедры физической химии, катализа и нефтехимии, Казахский национальный университет имени аль-Фараби Министерства образования и науки РК, г. Алматы.
Работа поступила в редакцию 14.07.2014.




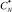 , %
, %
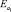 , кДж/моль
, кДж/моль
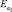 , кДж/моль
, кДж/моль