ВИЧ-инфекция, этиологическим агентом которой является вирус иммунодефицита человека типа 1 (ВИЧ-1), относится к особо опасным медленно прогрессирующим заболеваниям иммунной и центральной нервной систем. Вирус широко распространен в человеческой популяции. На конец 2012 г. по данным ВОЗ в мире насчитывалось более 35,3 млн ВИЧ-инфицированных человек [25]. ВИЧ инфицирует прежде всего клетки иммунной системы (Т-лимфоциты, макрофаги и дендритные клетки) и некоторые другие типы клеток, содержащие рецептор CD4. Инфицированные ВИЧ CD4+ Т-лимфоциты постепенно гибнут [26]. В результате этого субпопуляция CD4+ Т-лимфоцитов медленно сокращается и, как следствие, клеточный иммунитет снижается. При достижении критического уровня количества CD4+ Т-лимфоцитов организм становится восприимчивым к оппортунистическим (условно-патогенным) инфекциям, возбудителями которых являются Mycobacterium avium [14], Cryptosporidium parvum [13], Pneumocystis carinii [3], Toxoplasma gondii [19, 5], Cryptococcus neoformans [2], Histoplasma capsulatum [10] и Candida albicans [24], а также вирусы Herpes zoster [11], Herpes simplex type 1 и type 2 [12], цитомегаловирус [6, 4] и другие. При отсутствии высокоэффективной комплексной антиретровирусной терапии летальный исход наступает в течение 7–10 лет после инфицирования.
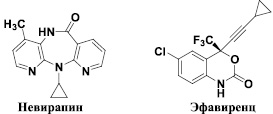
В настоящее время в комплексной терапии ВИЧ-инфекции и вызываемого ею синдрома приобретенного иммунодефицита (СПИД) широко применяются ненуклеозидные ингибиторы обратной транскриптазы (невирапин и эфавиренц) [15]. Данные ингибиторы связываются с вирусным ферментом в гидрофобном «кармане», удаленном от активного центра обратной транскриптазы приблизительно на 10 A. Следует отметить, что, несмотря на достаточно интенсивный поиск ненуклеозидных ингибиторов репликации ВИЧ-1, данная проблема продолжает оставаться в ряду наиболее актуальных и значимых. Это связано с двумя факторами: токсичностью препаратов, а также с высокой изменчивостью вируса, которая обуславливает появление лекарственно устойчивых его штаммов, особенно в ходе длительной терапии. Возникновение таких штаммов обусловлено заменами аминокислотных остатков в гидрофобном «кармане» связывания ненуклеозидных ингибиторов. Наибольшей клинической значимостью обладают мутации K103N, Y181C, Y188L и некоторые другие. Даже единичные мутации могут привести к резистентности высокой степени в отношении одного ингибитора или кросс-резистентности к ненуклеозидным ингибиторам [16]. В этой связи поиск новых противовирусных препаратов, эффективных как в отношении дикого штамма, так и в отношении клинически наиболее важных мутантных изолятов для лечения ВИЧ-инфекции и СПИД, является чрезвычайно актуальной проблемой.
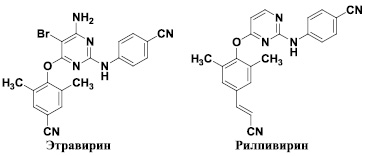
В последние годы в клиническую практику были введены препараты второго поколения – этравирин [7] и рилпивирин [21], которые обладают способностью подавлять репродукцию большинства штаммов вируса, устойчивых к действию невирапина и эфавиренца. Соответственно, они предназначены для лечения больных, которые ранее получали лечение препаратами первого поколения. Следует особо отметить тот факт, что уже к настоящему времени выявлены новые штаммы ВИЧ-1, которые обладают заметно меньшей чувствительностью к этравирину [20] и рилпивирину [17]. Кроме того, эти препараты также обладают определенной токсичностью и вызывают побочное действие у ряда пациентов. Следовательно, дальнейший поиск новых соединений, обладающих способностью блокировать репродукцию ВИЧ различных штаммов, по-прежнему остается актуальной задачей.
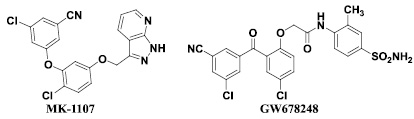
Среди ненуклеозидных ингибиторов обратной транскриптазы ВИЧ-1 второго поколения следует выделить производные диариловых эфиров (МК-1107) [9, 8] и производные бензофенона (GW678248) [22, 23], которые продемонстрировали ингибирующую активность как в отношении дикого, так и в отношении большинства мутантных штаммов ВИЧ-1 в клеточных культурах в наномолярном диапазоне концентраций. Ключевыми особенностями данных соединений являются способность к образованию водородных связей с главной цепью фермента – обратной транскриптазы ВИЧ – а также высокая конформационная мобильность их молекул. Однако основным недостатком данных соединений является относительно высокая токсичность.
Недавно нами были синтезированы соединения ряда 1, содержащие в своем составе остаток урацила, связанный с бензофеноновым фрагментом коротким мостиком, и изучены их вирусингибиторные свойства. Было показано, что соединения являются эффективными ингибиторами репродукции ВИЧ-1 в культуре МТ4 клеток и ключевого фермента репликации вируса – обратной транскриптазы как дикого типа, так и отношении большинства его мутантных вариантов. Однако соединения оказались практически неактивными в отношении V106A мутанта [1].
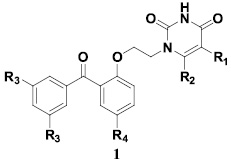
Цель исследования. В этой связи нами была предпринята попытка синтезировать соединения, которые были бы лишены данного недостатка. В качестве основы новых молекул 2 выступили соединения ряда 1, которые несли дополнительный феноксиэтильный заместитель у атома азота остатка урацила.
Результаты исследования и их обсуждение
Их синтез заключался в обработке 1-[2-(фенокси)этил]производных урацила 3, способ получения которых нами был ранее описан [18], эквимолярным количеством бромида 4 в растворе ДМФА в присутствии 1,5-кратного мольного избытка безводного карбоната калия при нагревании до 80 °С в течение 20 ч. При этом образовывались соответствующие 3-бензофенон-замещенные 1-[2-(фенокси)этил]производные урацила 2a – 2f, как это показано на схеме (рисунок).
Чистоту полученных соединений определяли методом тонкослойной хроматографии, строение – 1Н и 13С ЯМР-спектроскопией. Физико-химические свойства представлены в таблице.
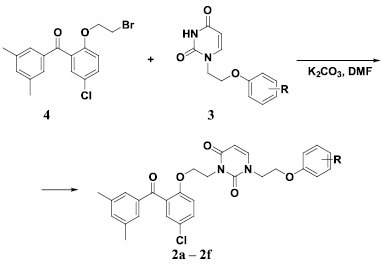
Схема синтеза 3-[2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этил]-1-[2-(фенокси)этил]производных урацила
Физико-химические свойства 3-[2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этил]-1-[2-(фенокси)этил] производных урацила 2a – 2f
|
Соединение |
R |
Выход, % |
Тпл, °C |
Rf* |
|
2a |
H |
70 |
133–135 |
0,31 |
|
2b |
3-Me |
66 |
128,5–130 |
0,46 |
|
2c |
4-Me |
83 |
127–129 |
0,40 |
|
2d |
4-t-Bu |
75 |
140–142 |
0,30 |
|
2e |
4-Cl |
90 |
148–149,5 |
0,34 |
|
2f |
4-CN |
83 |
112–114 |
0,31 |
Примечание. * этилацетат-гексан, 1:1.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H и 100 МГц для 13С) в ССl4 и ДМСО-D6, внутренний стандарт тетраметилсилан. Тонкослойную хроматографию выполняли на пластинах «Merk TLS Silica gel 60 F254» (Германия), используя в качестве элюента смесь этилацетат-гексан (1:1). Пластины проявляли с помощью УФ-лампы VL-6.LC (Франция). Для флэш-хроматографии использовали Kieselgel 60-200 μm, 60 A (Acros Organics). Температуры плавления измерены в стеклянных капиллярах на приборе «Mel-Temp3.0» (Laboratory Devices Inc., США).
Общая методика получения 3-[2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этил]-1-[2-(фенокси)этил]производных урацила 2a – 2f. К раствору 1,77 ммоль производного урацила 3 в 10 мл безводного ДМФА прибавили 0,4 г (2,89 ммоль) карбоната калия, полученную смесь перемешивали при 80 °С в течение 1 ч, затем прибавили 0,65 г (1,77 ммоль) 1-бром-2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этана (4) и реакционную массу перемешивали при той же температуре еще 20 ч. Охладили до комнатной температуры, профильтровали, фильтрат упарили при пониженном давлении, остаток экстрагировали горячим хлороформом, экстракт упарили и остаток чистили флэш-хроматографией на силикагеле и перекристаллизовали из смеси этилацетат-гексан (1:1).
3-[2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этил]-1-[2-(фенокси)этил]урацила (2a). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2.28 (6Н, с, 2×СН3), 3,91 (2Н, т, J = 6,6, CH2), 3,99 (2H, т, J = 5,3, CH2), 4,10 (2H, т, J = 6,1), 4,13 (2H, т, J = 4,9), 5,57 (1H, д, J = 7,8, H-5), 6,89-6,95 (2H, м, H-6″, H-4‴), 7,23-7,28 (7H, м, H-2′, H-4′, H-6′, H-2‴, H-3‴, H-5‴, H-6‴), 7,31 (1H, д, J = 2,7, H-3″), 7,53 (1H, дд, J = 9,0 и 2,6, H-5″), 7,62 (1H, д, J = 8,1, H-6). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 21,1; 48,4; 64,9; 65,3; 100,0; 114,8; 115,0; 121,3; 125,1; 127,2; 128,4; 129,8; 131,0; 131,5; 135,4; 136,8; 138,1; 145,0; 151,2; 154,5; 158,3; 162,5; 194,2.
3-[2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этил]-1-[2-(3-метилфенокси)этил]урацила (2b). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,24 (3Н, с, СН3), 2,28 (6Н, с, 2×СН3), 3,91 (2Н, т, J = 6,5, CH2), 3,98 (2H, т, J = 5,8, CH2), 4,08-4,12 (4H, м, 2×СН2), 5,56 (1H, д, J = 7,8, H-5), 6,67-6,75 (3H, м, H-6″, H-2‴, H-4‴), 7,13 (1H, т, J = 7,8, H-5‴), 7,22 (1H, c, H-4'), 7,24-7,26 (3H, м, H-2', H-6', H-6‴), 7,30 (1H, д, J = 2,7, H-3″), 7,52 (1H, дд, J = 8,9 и 2,7, H-5″), 7,60 (1H, д, J = 8,0, H-6). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 20,8; 21,1; 48,2; 64,7; 65,0; 99,8; 111,5; 114,8; 115,2; 121,8; 124,9; 127,0; 128,1; 129,3; 130,8; 131,2; 135,1; 136,6; 137,9; 139,1; 144,8; 150,9; 154,3; 158,0; 162,2; 194,0,
3-[2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этил]-1-[2-(4-метилфенокси)этил]урацила (2c). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,19 (3Н, с, СН3), 2,27 (6Н, с, 2×СН3), 3,91 (2Н, т, J = 6,3, CH2), 3,96 (2H, т, J = 5,1, CH2), 4,07-4,11 (4H, м, 2×СН2), 5,55 (1H, д, J = 7,8, H-5), 6,77 (2H, д, J = 8,6, H-3‴, H-5‴), 7,04 (2H, д, J = 8,0, H-2‴, H-6‴), 7,23-7,24 (4H, м, H-2', H-4', H-6', H-6″), 7,29 (1H, д, J = 2,6, H-3″), 7,50 (1H, дд, J = 8,9 и 2,8, H-5″), 7,59 (1H, д, J = 7,8, H-6). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 20,4; 21,0; 48,4; 65,0; 65,4; 100,0; 114,6; 115,0; 125,1; 127,2; 128,4; 130,0; 130,2; 131,0; 131,5; 135,3; 136,9; 138,1; 145,0; 151,2; 154,4; 156,2; 162,5; 194,2.
3-[2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этил]-1-[2-(4-трет-бутилфенокси)этил]урацила (2d). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 1,22 (9Н, с, 3×СН3), 2,27 (6Н, с, 2×СН3), 3,91 (2Н, т, J = 6,3, CH2), 3,97 (2H, т, J = 5,7, CH2), 4,09-4,11 (4H, м, 2×СН2), 5,55 (1H, д, J = 7,9, H-5), 6,81 (2H, д, J = 8,6, H-3‴, H-5‴), 7,23-7,26 (6H, м, H-2', H-4', H-6', H-6″, H-2‴, H-6‴), 7,30 (1H, д, J = 2,7, H-3″), 7,52 (1H, дд, J = 8,8 и 2,7, H-5″), 7,61 (1H, д, J = 7,8, H-6). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 21,1; 31,6; 34,1; 48,5; 64,9; 65,3; 100,0; 114,3; 115,0; 125,1; 126,4; 127,2; 128,4; 131,0; 131,5; 135,4; 136,8; 138,1; 143,5; 145,0; 151,2; 154,5; 156,0; 162,5; 194,2.
3-[2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этил]-1-[2-(4-хлорфенокси)этил]урацила (2e). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,27 (6Н, с, 2×СН3), 3,91 (2Н, т, J = 6,6, CH2), 3,98 (2H, т, J = 5,4, CH2), 4,10 (2Н, т, J = 6,1, CH2), 4,13 (2Н, т, J = 5,1, CH2), 5,56 (1H, д, J = 7,9, H-5), 6,93 (2H, д, J = 9,0, H-3‴, H-5‴), 7,22 (1H, c, H-4'), 7,24-7,25 (3Н, м, H-2', H-6', H-6″), 7,28-7,31 (3H, м, H-3″, H-2‴, H-6‴), 7,53 (1H, дд, J = 8,8 и 2,7, H-5″), 7,61 (1H, д, J = 7,8, H-6). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 21,1; 48,3; 64,9; 65,7; 100,1; 115,0; 116,6; 125,0; 125,1; 127,2; 128,4; 129,6; 131,0; 131,5; 135,4; 136,8; 138,1; 145,0; 151,2; 154,5; 157,1; 162,5; 194,2.
3-[2-[2-(3,5-диметилбензоил)-4-хлорфенокси]этил]-1-[2-(4-цианофенокси)этил]урацила (2f). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,28 (6Н, с, 2×СН3), 3,91 (2Н, т, J = 6,3, CH2), 4,01 (2H, т, J = 5,8, CH2), 4,10 (2Н, т, J = 6,1, CH2), 4,24 (2Н, т, J = 5,1, CH2), 5,57 (1H, д, J = 7,8, H-5), 7,08 (2H, д, J = 8,8, H-3‴, H-5‴), 7,22 (1H, c, H-4'), 7,24-7,25 (3H, м, H-2', H-6', H-6″), 7,30 (1H, д, J = 2,4, H-3″), 7,53 (1H, дд, J = 9,1 и 2,7, H-5″), 7,75 (1H, д, J = 7,8, H-6). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 21,1; 48,1; 60,1; 64,9; 65,9; 100,1; 103,6; 115,0; 115,9; 119,3; 125,1; 127,2; 128,4; 131,0; 131,5; 134,5; 135,3; 136,8; 138,1; 145,0; 151,2; 154,5; 161,7; 162,5; 194,2.
Выводы В ходе проведенной работы осуществлен синтез 6 новых производных урацила, содержащих бензофеноновый фрагмент, связанный коротким мостиком с положением 3 гетероцикла. Полученные соединения представляют интерес как потенциальные анти-ВИЧ-1 агенты.
Настоящая работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 13-04-91440.
Рецензенты:
Симонян А.В., д.фарм.н., профессор кафедры фармацевтической технологии и биотехнологии Волгоградского государственного медицинского университета, г. Волгоград;
Ганичева Л.М., д.фарм.н., доцент кафедры управления и экономики фармации, медицинского и фармацевтического товароведения Волгоградского государственного медицинского университета, г. Волгоград.
Работа поступила в редакцию 15.09.2014.



