Интраабдоминальная гипертензия (ИАГ) является одним из наиболее значимых факторов развития осложнений и неспецифическим проявлением различных хирургических заболеваний. Она является причиной возникновения абдоминального компартмент-синдрома [6, 11], составляющей патогенеза у больных перитонитом и острой кишечной непроходимостью [8], а также играет существенную роль в развитии системных расстройств [3]. Проблемам ранней диагностики и профилактики ИАГ в настоящее время посвящён ряд клинических и экспериментальных работ [2, 5, 10, 12], с которыми тесно коррелируют исследования патогенетических аспектов развития вентральных грыж [1]. Однако до настоящего времени остаются недостаточно изученными изменения функциональной активности желудочно-кишечного тракта при развитии ИАГ, лежащие в основе системных нарушений.
Цель работы: исследовать в эксперименте электрическую активность (ЭА) различных отделов желудка и двенадцатиперстной кишки в условиях моделирования ИАГ у крыс.
Материалы и методы исследования
Исследования проводили в двух сериях экспериментов на крысах-самцах линии Вистар массой 250–300 г. В качестве средства для наркоза использовали хлоралгидрат, который вводился внутрибрюшинно в дозировке 300 мг/кг животного. В опытных группах животных моделировали интраабдоминальную гипертензию путем создания дупликатуры в 1 см апоневроза по передней стенке брюшной полости [2]. Контролем служили ложно оперированные животные, которым производилась срединная лапаротомия без моделирования ИАГ. После проведения лапаротомии в нижний этаж брюшной полости экспериментального животного помещался стерильный силиконовый баллончик объемом 1 мл, трубочка выводилась наружу через контраппертуру [2]. Для измерения внутрибрюшного давления (ВБД) использовали водный манометр.
Исследования ЭА желудка и двенадцатиперстной кишки крыс проводили с использованием методики прямой многоканальной электрогастрографии. Для этого через 24 часа (1 серия) и 48 часов (2 серия) выполнялась повторная операция – релапаротомия с имплантацией регистрирующих электродов в желудок и двенадцатиперстную кишку. Серебряные петельчатые электроды [7] имплантировали в мышечную оболочку тела (ТЖ), пилорического отдела (ПО) желудка и двенадцатиперстной кишки (ДК) крысы. Одновременную запись ЭА гладких мышц исследуемых отделов ЖКТ осуществляли с помощью многоканального регистратора «Биоскрипт» (BST-1). Анализировали амплитуду медленных волн (МВ) ЭА, затем производили корреляционный анализ амплитудных характеристик ЭА.
Результаты исследования и их обсуждение
Анализ средних значений амплитуды электрической активности (ЭА) гладких мышц отделов желудка и двенадцатиперстной кишки позволил обнаружить их значимое снижение в пилорическом отделе желудка через 24 часа (серия № 1) после моделирования интраабдоминальной гипертензии (на 27 % по сравнению с контролем, р < 0,05). Через 48 часов (серия № 2) угнетение амплитуды ЭА становилось еще более выраженным, что выражалось в возрастании отличий значений опытной и контрольной групп до 39,7 % (р < 0,01). Средние значения амплитуды ЭА ТЖ становились меньше контрольных на 30,3 % (р < 0,01) через 48 часов после моделирования ИАГ (таблица).
Следует обратить внимание на изменение градиента амплитудных значений ЭА на фоне повышения внутрибрюшного давления. В контрольной группе животных наиболее высокие значения амплитуды электрической активности были зарегистрированы в гладких мышцах тела желудка. Они превышали средние значения амплитуды ЭА пилорического отдела желудка на 23,5 % (р < 0,05) и начального отдела двенадцатиперстной кишки на 30,5 % (р < 0,05). Через сутки после повышения внутрибрюшного давления соотношения между амплитудными значениями ЭА исследуемых отделов гастродуоденального комплекса крыс существенно изменялись. Значения амплитуды ЭА пилорического отдела желудка становились меньше средних значений амплитуды ЭА тела желудка на 49,1 % (р < 0,05) и двенадцатиперстной кишки на 56,8 % (р < 0,05).
Значения амплитуды электрической активности отделов желудка и двенадцатиперстной кишки крысы после моделирования интраабдоминальной гипертензии
|
Серии животных |
Группы животных |
ВБД (мм вод.ст.) |
Амплитуда ЭА (мВ) |
||
|
ТЖ |
ПО |
ДК |
|||
|
Серия № 1 |
Контроль |
12,36 ± 0,2 |
2,72 ± 0,2 |
2,21 ± 0,2 |
2,08 ± 0,1 |
|
Модель ИАГ |
75,71 ± 0,6 |
2,4 ± 0,1 |
1,61 + 0,1 (р < 0,05) |
2,53 ± 0,3 |
|
|
Серия № 2 |
Контроль |
12,51 ± 0,2 |
2,81 ± 0,2 |
2,34 ± 0,2 |
1,98 ± 0,1 |
|
Модель ИАГ |
85,47 ± 0,4 |
1,96 ± 0,1 (р < 0,01) |
1,41 ± 0,1 (р < 0,01) |
2,01 ± 0,2 |
|
Обнаруженные различия сохранялись и на вторые сутки после моделирования ИАГ. Сила возможных сокращений ПО желудка оставалась наименьшей. Средние значения амплитуды ЭА ПО желудка были меньше амплитудных значений ЭА ТЖ на 39,2 % (р < 0,05) и двенадцатиперстной кишки на 42,7 % (р < 0,05).
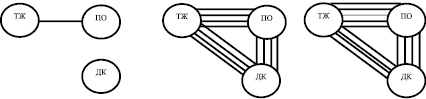
Корреляция амплитудных характеристик электрической активности отделов желудка и двенадцатиперстной кишки крысы после моделирования интраабдоминальной гипертензии. Примечание: значения коэффициентов корреляции обозначены линиями разной толщины: r = 0,1; r = 0,2
Был проведен корреляционный анализ амплитудных значений ЭА, который позволяет оценить уровень функциональной гетерогенности гастродуоденального комплекса [9]. У животных контрольной группы скоррелированность ЭА отделов ГДК по амплитуде была достаточно низкой. Статистически значимые коэффициенты корреляции рассчитывались только в сопоставлении ТЖ-ПО, их среднее значение составляло 0,201 ± 0,02. Скоррелированность между амплитудными значениями ЭА ТЖ и ДК, а также ПО и ДК практически отсутствовала (рисунок).
Полученные данные свидетельствуют о высоком уровне исходной функциональной гетерогенности гастродуоденального комплекса (ГДК), относительной автономности каждого из его отделов, что было показано многими авторами при исследованиях желудка человека и экспериментальных животных [4, 7, 9]. Через 24 часа после моделирования ИАГ на фоне повышения внутрибрюшного давления в 6,1 раза происходило повышение средних значений коэффициентов корреляции до 0,795 ± 0,04 (р < 0,01) в сопоставлении ТЖ-ПО, 0,771 ± 0,04 (р < 0,01) в сопоставлении ТЖ-ДК и 0,794 ± 0,04 (р < 0,01) в сопоставлении ПО-ДК. Повышение внутрибрюшного давления в 6,8 раза через 48 часов приводило к еще большему возрастанию скоррелированности амплитудных значений ЭА между ТЖ и ПО (r = 0,904 ± 0,02, р < 0,01). Значения r в других сопоставлениях составили 0,771 ± 0,04 (ТЖ-ДК) и 0,794 ± 0,04 (ПО-ДК). Картину изменений функциональных взаимоотношений между компонентами ГДК можно трактовать как явление утраты его функциональной гетерогенности вследствие нарастающей интраабдоминальной гипертензии.
Заключение
В данном экспериментальном исследовании выявлено, что повышение внутрибрюшного давления приводит к угнетению электрической активности гладких мышц желудка. В пилорическом отделе эти явления развиваются быстрее – в течение 24-х часов после моделирования ИАГ. На вторые сутки развитие ИАГ приводит к угнетению амплитуды ЭА гладких мышц пилорического отдела и тела желудка, что свидетельствует о снижении их сократительной активности. В то же время активность двенадцатиперстной кишки остается наиболее устойчивой к повышению внутрибрюшного давления в течение 2-х суток после моделирования ИАГ. Увеличение ВБД приводит к изменению уровня функциональной гетерогенности (ФГ) гастродуоденального комплекса. Этот факт подтверждают данные корреляционного анализа амплитудных характеристик ЭА, которые свидетельствуют о том, что в течение первых суток после моделирования ИАГ резко возрастает скоррелированность между всеми отделами ГДК. Ее дальнейшее нарастание приводит к утрате относительной автономности каждого из отделов. Учитывая ранее полученные нами данные об изменениях уровня ФГ при развитии патологических процессов в условиях моделирования острого повреждения пилорического отдела желудка и хронического нарушения дуоденальной проходимости [9], можно предположить, что снижение ФГ сопровождает декомпенсаторные изменения функций исследуемых органов. Таким образом, причины системных патологических изменений ЖКТ могут объясняться не только снижением сократительной способности гладких мышц желудка (в первую очередь, его пилорического отдела), но и нарушением исходных функциональных взаимоотношений между компонентами ГДК. При этом утрата функциональной гетерогенности ГДК может служить одним из наиболее информативных маркеров формирования устойчивых патологических систем вследствие развития интраабдоминальной гипертензии.
Рецензенты:
Бежин А.И., д.м.н., профессор, заведующий кафедрой оперативной хирургии и топографической анатомии им. профессора А.Д. Мясникова, Курский государственный медицинский университет, г. Курск;
Ляшев Ю.Д., д.м.н., профессор кафедры патофизиологии Курского государственного медицинского университета, г. Курск.
Работа поступила в редакцию 18.09.2014.



