В последнее десятилетие интенсивно развивается химия дигалогенидов селена, которые зарекомендовали себя как эффективные и селективные реагенты в синтезе селеноорганических соединений. Несмотря на то, что дихлорид и дибромид не могут быть выделены в индивидуальном виде [8], эти реагенты могут быть получены in situ и немедленно вовлечены в разнообразные превращения [1–7, 9–13].
Нами систематически изучаются реакции дихлорида и дибромида селена с соединениями, содержащими двойную связь [1–7]. На основе реакции дигалогенидов селена с дивинилсульфидом получены новые 5-членные гетероциклические соединения, 5-галоген-2-галогенметил-1,3-тиаселеноланы – продукты присоединения как в α-, так и в β-положения двойных связей дивинилсульфида [1, 6, 7]. В то время как реакция дигалогенидов селена с дивинилсульфидом изучена достаточно хорошо, присоединение дигалогенидов селена к моновинилсульфидам до настоящего времени не описано в литературе.
Материалы и методы исследования
Дихлорид селена получен взаимодействием элементного селена с хлористым сульфурилом [9, 12]. Дибромид селена синтезирован из элементного селена и брома [9, 12].
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400,13, и 100,61 МГц соответственно) в CCl4, внутренний стандарт – ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
Типичная методика. Раствор дибромида селена [получен из элементного селена (0,79 г, 10 ммоль) и брома (1,60 г, 10 ммоль) [9, 12]] в 20 мл CCl4 добавили по каплям к охлажденному до –20 °С раствору бензилвинилсульфида (1,5 г, 10 ммоль) в 50 мл CCl4, перемешивали 4 ч при температуре –20 °С и 40 ч при комнатной температуре. Смесь фильтровали, растворитель отогнали на роторном испарителе, остаток сушили в вакууме.
Результаты исследования и их обсуждение
В продолжение систематических исследований реакций дихлорида и дибромида селена с ненасыщенными халькогенидами [1–7] нами изучено присоединение дихлорида и дибромида селена к бензилвинилсульфиду (1) и фенилвинилсульфиду (2). На основе этой реакции разработаны эффективные региоселективные способы получения ранее неизвестных бис(2-бензилсульфанил-2-галогенэтил)селенидов (3, 4) и бис(2-фенилсульфанил-2-галогенэтил)селенидов (5, 6).
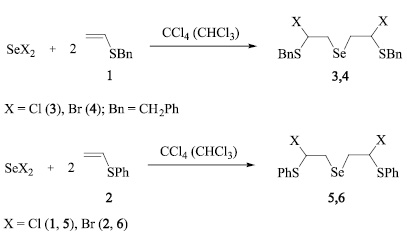
Реакции осуществлялись в среде четыреххлористого углерода или хлороформа при мольном соотношении винилсульфида и дигалогенида селена 2:1. Раствор дигалогенида селена добавляли по каплям к охлажденному раствору винилсульфида (при температуре –20 °С в четыреххлористом углероде или –60 °С в хлороформе) и перемешивали при этой температуре 4 ч, затем смесь перемешивалась 40 ч при комнатной температуре.
Установлено, что реакции дибромида селена с винилсульфидами 1, 2 региоселективно протекают в среде четыреххлористого углерода, давая селениды (4, 6) с выходом 85–90 %, в то время как хлорсодержащие продукты (3, 5) селективно образуются в среде хлороформа (выход 80–86 %). При проведении реакции дихлорида селена с винилсульфидами 1, 2 в четыреххлористом углероде, наряду с соединениями 3, 4 (выход 70–78 %), наблюдается образование побочных соединений, которые, судя по данным ЯМР, являются продуктами присоединения против правила Марковникова. Можно предполагать, что реакции дигалогенидов селена с винилсульфидами протекают через образование промежуточных продуктов присоединения против правила Марковникова 7–10 (кинетические продукты), которые изомеризуются в термодинамически более устойчивые соединения 3–6. Реакция изомеризации легче протекает с бромистыми продуктами 4, 6, чем с их хлорсодержащими аналогами 3, 5. В то же время изомеризация быстрее идет в более полярном хлороформе, чем в неполярном четыреххлористом углероде. Таким образом, в реакции дибромида селена с сульфидами 1, 2 промежуточные продукты присоединения против правила Марковникова 9, 10 переходят в соединения 5, 6 как в хлороформе, так и в CCl4, в то время как в реакциях дихлорида селена в среде четыреххлористого углерода остаются некоторые количества продуктов присоединения против правила Марковникова 7, 8. Однако в хлороформе эти соединения почти полностью изомеризуются в термодинамические продукты 3, 5. Подобные закономерности наблюдались нами в некоторых других реакциях, например в реакциях присоединения дигалогенидов селена по двойной связи аллилфенилового эфира, которые протекают через образование кинетических продуктов присоединения против правила Марковникова с последующей изомеризацией в термодинамически более устойчивые продукты присоединения по правилу Марковникова [12].
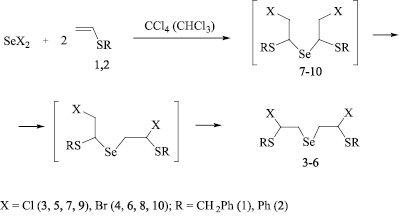
Соединения 3-6 – перспективные полупродукты и синтоны для синтеза функциональных селенорганических соединений. Их строение доказано методами ЯМР 1H и 13C и подтверждено данными элементного анализа. Значения констант спин-спинового взаимодействия атома селена с атомом углерода, имеющим два протона, для соединений 3–6 составляет около 68 Гц, что соответствует прямым константам спин-спинового взаимодействия (1JCSе). Это указывает на присоединение атома селена к терминальному атому углерода винильной группы и образование продуктов присоединения по правилу Марковникова.
Бис(2-бензилсульфанил-2-хлорэтил)селенид (3), маслообразное вещество темного цвета. Спектр ЯМР 1Н (400,13 МГц, CDCl3, d, м.д.): 3,18-340 м (8Н, CH2, SeCH2), 4,16 м (2H, CHCl), 7,24-7,48 м (10Н, Ph). ЯМР 13С (100,61 МГц, CDCl3, d, м.д.): 32,79 (SeCH2, 1JC-Se = 68 Гц), 35,72 (CH2), 67,17 CHCl), 127,24 (Ph), 128,54 (Ph), 129,48 (Ph), 136,68 (Ph). Найдено (%): С, 47,78; Н, 4,29; Cl, 16,02, C18H20Cl2S2Se. Вычислено (%): С, 48,01; Н, 4,48; Cl, 15,74,
Бис(2-бензилсульфанил-2-бромэтил)селенид (4), маслообразное вещество темного цвета. Спектр ЯМР 1Н (400,13 МГц, CDCl3, d, м.д.): 3,20-335 м (8Н, CH2, SeCH2), 4,50 м (2H, CHBr), 7,30-7,50 м (10Н, Ph). ЯМР 13С (100,61 МГц, CDCl3, d, м.д.): 33,83 (SeCH2, 1JC-Se = 68 Гц), 44,31 (CH2), 55,55 CHBr), 127,37 (Ph), 128,83 (Ph), 129,69 (Ph), 137,93 (Ph). Найдено (%): С, 39,84; Н, 3,61; Br, 29,89, C18H20Br2S2Se. Вычислено (%): С, 40,09; Н, 3,74; Br, 29,64,
Бис(2-бензилсульфанил-2-хлорэтил)селенид (5), маслообразное вещество темного цвета. Спектр ЯМР 1Н (400,13 МГц, CDCl3, d, м.д.): 3,20-3,43 м (4Н, SeCH2), 4,28 м (2H, CHCl), 7,14-7,42 м (10Н, Ph). ЯМР 13С (100,61 МГц, CDCl3, d, м.д.): 33,56 (SeCH2, 1JC-Se = 68 Гц), 69,27 (CHCl), 127,84 (Ph), 128,14 (Ph), 131,08 (Ph), 136,79 (Ph). Найдено (%): С, 45,78; Н, 4,01; Cl, 17,03, C16H16Cl2S2Se. Вычислено (%): С, 45,51; Н, 3,82; Cl, 16,79,
Бис(2-бензилсульфанил-2-бромэтил)селенид (6), маслообразное вещество темного цвета. Спектр ЯМР 1Н (400,13 МГц, CDCl3, d, м.д.): 3,20-335 м (4Н, CH2, SeCH2), 4,50 м (2H, CHBr), 7,30-7,50 м (10Н, Ph). ЯМР 13С (100,61 МГц, CDCl3, d, м.д.): 34,03 (SeCH2, 1JC-Se = 68 Гц), 57,18 (CHBr), 127,67 (Ph), 128,34 (Ph), 130,29 (Ph), 138,45 (Ph). Найдено (%): С, 37,35; Н, 3,02; Br, 31,53, C16H16Br2S2Se. Вычислено (%): С, 37,59; Н, 3,15; Br, 31,26,
Выводы
На основе реакций дихлорида и дибромида селена к бензилвинилсульфиду и фенилвинилсульфиду разработаны эффективные региоселективные способы получения ранее неизвестных продуктов присоединения по правилу Марковникова, бис(2-бензилсульфанил-2-галогенэтил)селенидов и бис(2-фенилсульфанил-2-галогенэтил)селенидов.
Работа выполнена в рамках проекта Российского научного фонда (№ 13-14-01085).
Рецензенты:
Мартынов А.В., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск;
Артемьев А.В., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск.
Работа поступила в редакцию 12.11.2014



