Моноаминоксидазы (МАО) – оксидоредуктазы, дезаминирующие моноамины, обладают широкой субстратной специфичностью. Основная функция МАО – поддержание физиологических концентраций эндогенных моноаминов в тканях. Наибольшую активность МАО проявляют в печени, желудке и кишечнике, почках, а также в нервной системе. В нервной системе МАО являются ключевым ферментом метаболизма моноаминов – нейротрансмиттеров, и во многом обеспечивают нейрохимический контроль поведения. В желудочно-кишечном тракте МАО ограничивают избыточное поступление моноаминов с пищей [2]. В печени и почках МАО активно участвуют в метаболизме эндо- и экзогенных моноаминов, что дает основания относить их к ферментам первой фазы биотрансформации ксенобиотиков [4].
Копродуктом окислительного дезаминирования биогенных аминов под действием МАО является пероксид водорода (H2O2), который участвует в генерации других активных форм кислорода. По этой причине МАО сегодня считаются не только ключевыми ферментами обмена биогенных аминов, но и активными участниками свободнорадикальных процессов, в определенных ситуациях ответственных за проявления оксидативного стресса [2]. Чрезмерная активация и/или трансформация каталитических свойств МАО может привести к повреждениям печени [5] за счет активации свободнорадикального окисления.
Существенное влияние на функционирование генов, кодирующих изоформы МАО и определяющих их количество и активность, а также некоторые каталитические свойства ферментов в клетке, оказывают глюкокортикоидные гормоны [8]. По этой причине патологические состояния, сопровождающиеся стойкой дисфункцией гипоталамо-гипофизарно-адренокортикальной системы, с высокой степенью вероятности могут привести к изменениям активности МАО и трансформации их каталитических свойств. Одним из наиболее распространенных и социально значимых заболеваний такого рода является посттравматическое стрессовое расстройство (ПТСР), тяжёлое психическое состояние, которое сопровождается сохранением высокого уровня тревожности на протяжении длительного времени после психологической травмы. К настоящему моменту является бесспорным факт наличия при ПТСР нарушений функционирования гипоталамо-гипофизарно-адренокортикальной системы. Причем в подавляющем большинстве случаев сообщается о стойкой гипокортизолемии у данной категории лиц [10]. Эти расстройства сопровождаются изменениями обмена и биогенных аминов и активности церебральных МАО, а также чрезвычайно высокой частотой сопутствующих заболеваний, среди которых весьма распространена патология печени [7, 10].
Учитывая обозначенные выше особенности функционирования МАО, можно предположить, что изменения их каталитической активности в печени при ПТСР могут привести к развитию окислительного стресса в органе, а также существенным изменениям биотрансформации некоторых ксенобиотиков-моноаминов, метаболизируемых при участии МАО. К ним относят лекарственные препараты – производные фенилэтиламина (ибопамин, докарпамин); некоторые агонисты и антагонисты β-адренорецепторов (фенилэфрин, пропранолол, метопролол, и др.); агонисты серотониновых рецепторов (суматриптан, золмитриптан и др.). При активном участии моноаминоксидаз метаболизируются и некоторые ингибиторы МАО (алмоксатон, лазабемид) [4], которые в настоящее время широко применяются в лечении ПТСР.
Цель исследования: характеристика каталитических свойств моноаминоксидаз печени при экспериментальном моделировании ПТСР.
Материалы и методы исследования
Исследование выполнено на 40 белых беспородных лабораторных крысах. Посттравматические стрессовые расстройства моделировали путем содержания животных в условиях постоянного и неизбегаемого воздействия сильного безусловного раздражителя [6]. Контрольную группу составили интактные животные, не подвергавшиеся стрессорным воздействиям (n = 16). Для оценки динамики изменений активности ферментов и содержания продуктов свободнорадикального окисления сформировано четыре опытных группы. Продолжительность воздействия для всех групп составляла 10 суток. Первая опытная группа после десятисуточного воздействия стрессора содержалась в обычных условиях еще в течение 3 суток, вторая – 7 суток, третья – 14 суток (n = 8). В суспензии митохондрий, выделенных из гомогенатов печени, определяли активность МАО (в качестве субстратов использовали бензиламин, серотонин и глюкозамин) [2, 3], содержание молекулярных продуктов перекисного окисления липидов (ПОЛ), уровень спонтанной и металл-катализируемой окислительной модификации белков (ОМБ) по уровню карбонилированных белков и битирозина [1]. Использованный в работе методический подход, подразумевающий параллельное применение нескольких субстратов – моноаминов и внесение индукторов окислительного стресса (Fe2+/H2O2) в инкубационную смесь с последующей регистрацией ферментативной активности по выделению аммиака, позволяет оценить изменение каталитических свойств МАО-А [2]. Все исследования проведены одномоментно.
Результаты обработаны методами вариационной статистики и выражены в виде средней арифметической и ее стандартной ошибки (M ± m). Оценка статистической значимости различий осуществлялась с помощью непараметрических критериев. Статистические взаимосвязи изучали при помощи непараметрического корреляционного анализа, выполняя расчёт коэффициентов корреляции рангов по Спирмену (Rs).
Результаты исследования и их обсуждение
На третьи сутки после завершения стрессорных воздействий в суспензии митохондрий печени были выявлены признаки активации перекисного окисления липидов (таблица). На фоне уменьшения содержания вторичных изопропанол-растворимых продуктов в ответ на индукцию ПОЛ Fe2+/аскорбат (что свидетельствует о снижении антиоксидантного резерва фосфолипидов) увеличивалось содержание изопропанол-растворимых шиффовых оснований.
Статистически значимых изменений активности МАО при этом не наблюдалось. Тем не менее возможной причиной активации липопероксидации фосфолипидов в данном случае может быть усиление продукции пероксида водорода МАО-Б, активность которой имела статистически незначимую тенденцию к увеличению (рисунок).
Содержание продуктов свободнорадикального окисления в суспензии митохондрий печени на различных сроках экспериментального моделирования ПТСР
|
Показатель |
Контроль (n = 16) |
3 суток (n = 8) |
7 суток (n = 8) |
14 суток (ПТСР) (n = 8) |
|
Диеновые конъюгаты (гептановая фаза), е.о.и. |
0,99 ± 0,01 |
* 0,96 ± 0,01 |
0,97 ± 0,01 |
1,01 ± 0,01 |
|
Шиффовы основания (гептановая фаза), е.о.и. |
0,01 ± 0,002 |
0,02 ± 0,001 |
0,02 ± 0,001 |
0,01 ± 0,002 |
|
Диеновые конъюгаты (изопропанольная фаза), е.о.и. |
0,45 ± 0,01 |
0,48 ± 0,01 |
0,45 ± 0,01 |
* 0,38 ± 0,01 |
|
Кетодиены и сопряжённые триены (изопропанольная фаза), е.о.и. |
0,20 ± 0,01 |
0,22 ± 0,01 |
0,20 ± 0,01 |
* 0,15 ± 0,01 |
|
Шиффовы основания (изопропанольная фаза), е.о.и. |
0,01 ± 0,003 |
* 0,03 ± 0,003 |
0,02 ± 0,001 |
* 0,00 ± 0,00 |
|
Диеновые конъюгаты (изопропанольная фаза, индукция Fe2+/аскорбат), е.о.и. |
2,24 ± 0,23 |
1,93 ± 0,29 |
2,03 ± 0,35 |
* 2,87 ± 0,18 |
|
Кетодиены и сопряжённые триены (изопропанольная фаза, индукция Fe2+/аскорбат), е.о.и. |
3,54 ± 0,26 |
* 2,65 ± 0,42 |
3,97 ± 0,42 |
4,01 ± 0,37 |
|
Окислительная модификация белков, мкмоль/г белка |
12,87 ± 3,26 |
12,55 ± 2,56 |
9,56 ± 1,98 |
* 7,51 ± 0,45 |
|
Окислительная модификация белков (индукция Fe2+/H2O2), мкмоль/ г белка |
32,39 ± 1,34 |
37,72 ± 2,42 |
* 39,21 ± 2,98 |
34,27 ± 2,27 |
|
Битирозин, ЕД/ г белка |
6,08 ± 0,71 |
6,12 ± 0,53 |
6,00 ± 0,44 |
5,66 ± 0,98 |
Примечание. * – статистически значимые отличия от соответствующего показателя контрольной группы; е.о.и. – единицы окислительного индекса.
Данное предположение также подтверждается наличием корреляционных взаимосвязей между активностью МАО-Б и содержанием вторичных гептан-растворимых продуктов ПОЛ и уровнем ОМБ (Rs = 0,76, P = 0,03 и Rs = 0,9, P = 0,002 соответственно). В свою очередь, активация свободнорадикального окисления может быть причиной изменения субстратной специфичности МАО-А. Выявлены корреляционные взаимосвязи между активностью дезаминирования глюкозамина и содержанием первичных (Rs = 0,73, P = 0,04), вторичных (Rs = 0,86, P = 0,006) и конечных (Rs = 0,73, P = 0,04) гептан-растворимых продуктов ПОЛ, а также уровнем ОМБ (Rs = 0,73, P = 0,04) в суспензии митохондрий печени. При этом активность дезаминирования серотонина (МАО-А) имела прямую взаимосвязь с уровнем вторичных гептан-растворимых продуктов ПОЛ (Rs = 0,81, P = 0,01) и обратную (Rs = –0,88, P = 0,004) с уровнем ОМБ, а также наблюдались статистически незначимые тенденции к уменьшению активности дезаминирования серотонина и увеличению активности дезаминирования глюкозамина.
На седьмые сутки после завершения воздействия стрессора обозначенные выше тенденции реализовались в виде статистически значимого увеличения активности МАО-Б и активации окислительного дезаминирования глюкозамина (рисунок), что сопровождалось усилением металл-катализируемого окисления белков (таблица). Выявлены корреляционные взаимосвязи между активностью МАО-Б и уровнем вторичных (Rs = 0,89, P = 0,007) и конечных (Rs = 0,92, P = 0,003) гептан-растворимых продуктов ПОЛ. Содержание продуктов ПОЛ соответствовало контрольному уровню, а зависимости между активностью окислительного дезаминирования глюкозамина и уровнем продуктов липопероксидации изменили свою направленность: выявлены корреляционные взаимосвязи между активностью дезаминирования глюкозамина и уровнем первичных гептан- (Rs = –0,78, P = 0,04) и изопропанол-растворимых (Rs = –0,96, P = 0,0004) первичных продуктов ПОЛ.
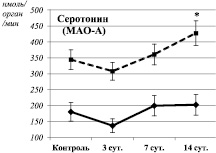
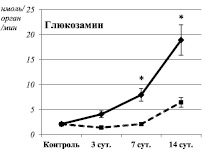
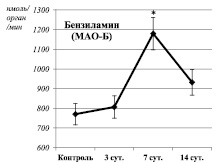
Изменения активности окислительного дезаминирования моноаминов в суспензии митохондрий печени крыс на различных сроках экспериментального моделирования ПТСР. Примечания: * – статистически значимые отличия от соответствующего показателя контрольной группы. Сплошная линия – спонтанная активность. Пунктирная линия – активность дезаминирования в ответ на введение в инкубационную смесь индуктора окислительного стресса (Fe2+/H2O2)
Через 14 суток после окончания стрессорных воздействий наблюдалось одновременное угнетение процессов ПОЛ и ОМБ (таблица), а также снижение активности МАО-Б до уровня контрольных значений (рисунок). Подобного рода дисбаланс между функционированием про- и антиоксидантных систем достаточно широко обсуждается в настоящее время. Считается, что так называемый «восстановительный стресс», в противоположность окислительному, связан с угнетением нормальных процессов свободнорадикального окисления и может иметь еще более негативные последствия [9]. Очевидно, возникший дисбаланс повлиял и на каталитическую специфичность МАО: наблюдалась одновременная активация спонтанного дезаминирования глюкозамина и дезаминирования серотонина в ответ на введение в инкубационную смесь индуктора окислительного стресса. При этом интенсивность дезаминирования серотонина имела прямую взаимосвязь с уровнем ОМБ (Rs = 0,95, P = 0,0002) (рисунок). Таким образом, на фоне выраженного дисбаланса между про- и антиоксидантными системами наблюдается трансформация каталитических свойств МАО-А.
Заключение
Поскольку моноаминоксидазы являются интегральными белками внешней мембраны митохондрий, их функционирование зависит от состояния липидного микроокружения. Частичное окисление сульфгидрильных групп моноаминоксидазы типа А (но не Б) сопровождается изменением субстратной специфичности (трансформацией каталитических свойств) и появлением качественно новых реакций дезаминирования соединений, которые обычно являются субстратами диаминоксидаз, и даже соединений, не принадлежащих к числу субстратов аминоксидаз [2]. В ходе нашего исследования выявлены как качественные, так и количественные изменения активности моноаминоксидаз печени при экспериментальном моделировании ПТСР. Окислительный стресс, также меняющий качественные и количественные характеристики на различных сроках наблюдения, может являться как причиной изменений в дезаминировании аминов, так и его следствием. Увеличение активности МАО-Б могло быть причиной прооксидантных сдвигов на 3 и 7 сутки после завершения воздействия стрессора, что в свою очередь привело к изменениям субстратной специфичности МАО-А на 7 и 14 сутки.
Рецензенты:Волчегорский И.А., д.м.н., профессор, заведующий кафедрой фармакологии, ГБОУ ВПО «Южно-Уральский государственный медицинский университет» Минздрава РФ, г. Челябинск;
Рябинин В.Е., д.б.н., профессор кафедры биологической химии, ГБОУ ВПО «Южно-Уральский государственный медицинский университет» Минздрава РФ, г. Челябинск.
Работа поступила в редакцию 19.12.2014.



