В микробных популяциях под влиянием экологических факторов формируется определенное количество бактерий с признаками анабиоза, они не культивируются в лабораторных условиях [1, 9, 10, 11]. Иногда даже значительное количество бактерий может переходить в жизнеспособное некультивируемое состояние [2, 3, 4, 5]. Это свойство бактерий можно рассматривать как своеобразную форму сохранения микроорганизма как вида.
Цель исследований – изучение мониторинга фенотипической изменчивости P. aeruginosa в связи с возникновением ИСМП.
Задачи
1. В опытах на кроликах породы шиншилла изучить мониторинг фенотипической изменчивости P. aeruginosa, проявляющейся в переходе культивируемых форм бактерий в некультивируемые и наоборот в зависимости от экологических условий окружающей среды.
2. Изучить антибиотикорезистентность культивируемых и некультивируемых бактерий P. aeruginosa.
3. Установить эпидемиологическую значимость некультивируемых форм P. aeruginosa в возникновении ИСМП.
Материалы и методы исследований
Экспериментальные исследования на кроликах породы шиншилла проведены на базе вивария ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья». Под наблюдением находилось 26 кроликов. Здоровых животных массой 2500–3500 грамм содержали в клетках в соответствии с требованиями санитарных правил (Утв. Главным Государственным санитарным врачом № 1045-73). В виварии поддерживали температуру воздуха 24–26 °С в соответствии с приказом МЗ РФ № 267 от 19.06.2003 и требованиями Европейской конвенции (Страсбург, 1986) по содержанию, кормлению и уходу за подопытными животными, выводу их из эксперимента и последующей утилизации. Для изучения фенотипической изменчивости бактерий P. aeruginosa были взяты здоровые кролики с нормальными физиологическими показателями [6].
Под наблюдением находилось 2 группы животных. Одной группе животных вводили подкожно культивируемые бактерии P. aeruginosa и S. aureus в концентрациях 105 степени микробных клеток, а другой – некультивируемые бактерий P. аeruginosa и S. aureus в такой же концентрации.
Микробиологические исследования проводили по общепринятым методикам в соответствии с требованиями приказа М3 РФ № 535 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». Идентифицировали бактерии, используя руководство Берджи [7], выделение некультивируемых бактерий проводили по методике, предложенной Л.Б. Козловым с соавт. [8]. В различные сроки инфекционного процесса кроликов вскрывали и определяли концентрацию культивируемых и некультивируемых бактерий P. aeruginosa в органах животных, а также определяли наличие бактерий P. aeruginosa в воздухе и на различных предметах вивария. Всего проведено 326 микробиологических исследований.
Для изучения микробной обсемененности внутренних органов животных использовали метод определения «бактерийного индекса» селезенки. После извлечения органа в асептических условиях его взвешивали на электронных лабораторных весах JW-1 высокого класса точности. На каждые 100 мг веса органа прибавляли 1 мл стерильного изотонического раствора NaCL и в стерильной ступке путем растирания получали основную взвесь тканей органов. Затем из основной взвеси делали ряд последовательных десятикратных разведений и 0,1 мл каждого разведения высевали на элективные. питательные среды. Через 24 часа роста бактерий при 37 °С подсчитывали количество выросших колоний. Показателем «бактериального индекса» являлось среднее число выросших колоний, полученных после посева органов от нескольких животных, взятых в опыт.
Статистическую обработку результатов исследования осуществляли с помощью компьютерной программы Statistika v 6.0, с использованием средней арифметической ошибки (М ± m).
Результаты исследования и их обсуждение
На 8 день после инфицирования кроликов культивируемыми бактериями происходила транслокация бактерий P. aeruginosa в легочную ткань и печень. В легких определялись культивируемые бактерии в количестве 3,0 ± 0,3∙103, а в печени – 6,95 ± 0,2∙104 микробных клеток в 1 грамме ткани животного. В стадии реконвалесценции инфекционного заболевания в почках наблюдался переход культивируемых бактерий в некультивируемое состояние (табл. 1).
В период клинических проявлений болезни после инфицирования кроликов некультивируемыми бактериями наблюдался переход некультивируемых бактерий P. aeruginosa в культивируемое состояние. В печени животных на 2–6 сутки культивируемые бактерии P. aeruginosa определялись в количестве 7,3 ± 1,4∙102 микробных клеток в 1 грамме печени. В период реконвалесценции (на 8–21 день после заражения животных) из печени выделить культивируемые бактерии P. aeruginosa не удалось. В почках наблюдался переход культивируемых бактерий в некультивируемое состояние (табл. 2).
Таблица 1
Концентрация культивируемых и некультивируемых бактерий P. aeruginosa в почках животных в различные периоды инфекционного заболевания
|
Сроки обследования животных (в сутках) |
Количество культивируемых бактерий |
Количество некультивируемых бактерий |
|
8 |
4,6 ± 0,1∙104 |
0 |
|
9 |
3,2 ± 0,1∙103 |
0 |
|
11–13 |
0 |
24,1 ± 12,2∙101 |
|
21 |
0 |
32,6 ± 11,4∙103 |
Примечание. 0 – бактерии не выделялись.
Таблица 2
Концентрация культивируемых и некультивируемых бактерий P. aeruginosa в почках животных в различные периоды инфекционного заболевания
|
Сроки обследования животных (в сутках) |
Количество культивируемых бактерий |
Количество некультивируемых бактерий |
|
2 |
2,0 ± 0,3∙102 |
0 |
|
6 |
0,6 ± 0,1∙102 |
0 |
|
8 |
0 |
22,3 ± 10,7∙101 |
|
21 |
0 |
29,6 ± 13,2∙102 |
Примечание. 0 – бактерии не выделялись.
Через 21 день после проведения экспериментов на кроликах в виварии проведено исследование воздуха методом аспирации с использованием пробоотборного устройства ПУ-1Б и проведены смывы с различных предметов в виварии. Результаты исследований показали, что культивируемые бактерии в помещении вивария не определялись, а концентрация некультивируемых бактерий в воздухе достигала 101, а на исследуемых поверхностях вивария достигала 103 микробных клеток в 1 мл смыва.
Проведенные исследования показали, что наблюдается фенотипическая изменчивость возбудителя инфекционного заболевания P. aeruginosa. В зависимости от экологических условий существования P. aeruginosa при микробиологических исследованиях определялись культивируемые и/или некультивируемые формы микроорганизма. Под влиянием защитных специфических и неспецифических факторов макроорганизма, а также при неблагоприятных условиях существования микроорганизма во внешней среде культивируемые бактерии переходили в некультивируемое состояние, а при создании благоприятных условий для размножения в макроорганизме бактерии переходили в культивируемое состояние и вызывали развитие инфекционного процесса в организме кроликов. Выявленная фенотипическая изменчивость P. aeruginosa позволяет сохранить возбудитель инфекционного заболевания как вид в неблагоприятных условиях окружающей среды.
Наблюдаемые изменения фенотипической изменчивости P. aeruginosa можно представить в виде следующей схемы (рисунок).
Изучена антибиотикорезистентность культивируемых и некультивируемых бактерий P. aeruginosa, выделенных от больных с различными клиническими инфекционными заболеваниями, находящихся на стационарном лечении в клиниках г. Тюмени. Под наблюдением находилось 116 больных. Использовали диски со следующими антибиотиками: ампициллин, имипенем, рифампицин, цефтриаксон и гентамицин. По результатам роста на среде Мюллера – Хинтона выделенных культур P. aeruginosa установлено, что имеются различия в диаметрах задержки роста бактерий к различным антибиотикам у культивируемых и некультивируемых бактерий. Диаметр задержки роста к антибиотикам у некультивируемых бактерий был на 6,8 ± 0,9 мм меньше по сравнению с культивируемыми бактериями. Различие в антибиотикорезистентности культивируемых и некультивируемых бактерий P. aeruginosa также свидетельствует о фенотипической изменчивости данного вида бактерий.
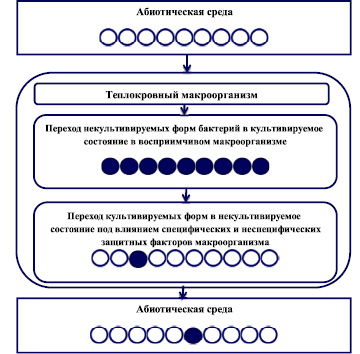
Принципиальная схема фенотипической изменчивости P. aeruginosa в зависимости от экологии возбудителя. Условные обозначения: – Некультивируемые бактерии P. aeruginosa – Культивируемые бактерии P. aeruginosa
Результаты проведенных микробиологических исследований показали, что между синегнойной палочкой и золотистым стафилококком наблюдался односторонний антагонизм. Поэтому условий для репродукции S. aureus не наблюдалось.
Заключение
Выявленная фенотипическая изменчивость P. aeruginosa, позволяющая сохранить возбудитель инфекционного заболевания как вид в неблагоприятных условиях существования, открывает новые возможности в совершенствовании эпидемиологического надзора за возбудителями инфекционных заболеваний, а именно проведение мониторинга за возбудителями инфекционных заболеваний по выявлению некультивируемых форм бактерий в макроорганизме и во внешней среде. Проведение эпидемиологического надзора за возбудителями инфекционных заболеваний с учетом их фенотипической изменчивости (переход культивируемых форм бактерий в некультивируемые и наоборот) позволит совершенствовать эпидемиологический надзор за ИСМП в ЛПУ.
Рецензенты:Мальчевский В.А., д.м.н., главный научный сотрудник отдела протекторных механизмов репродуктивных систем криосферы, ФГБУН «Тюменский научный центр» СО РАН, г. Тюмень;
Разин М.П., д.м.н., профессор, заведующий кафедрой детской хирургии, Кировская государственная медицинская академия, г. Киров.
Работа поступила в редакцию 02.02.2015.



