Актуальность изучения патогенеза нарушений консолидации при переломах костей конечностей определяется значительной частотой возникновения данных осложнений, трудностью их лечения и высоким уровнем инвалидности [6].
Доказано, что к одним из основных факторов, определяющих особенности исхода при переломах, относится иммунная система, нарушение которой может приводить к развитию различных осложнений, в том числе и нарушений консолидации [4]. Иммунные клетки секретируют многочисленные медиаторы (цитокины), играющие ключевую роль в репаративных процессах [2]. Одним из таких медиаторов является трансформирующий фактор роста бета 1 (TGFβ1). TGFβ1 – мультипотентный цитокин, являющийся важным модулятором клеточного роста, воспаления, пролиферации и дифференцировки, внеклеточного матричного депонирования и апоптоза [11]. TGFβ1 активирует фибробласты, способствует процессам репарации ран и непосредственно стимулирует ангиогенез [3]. Согласно исследованиям последних лет, важная роль в развитии осложнений отводится наследственным факторам. Генетически запрограммированный повышенный или пониженный синтез цитокинов является существенным в предрасположенности к развитию осложнений или заболеваний [1]. Ген TGFβ1 – высокополиморфный участок генома, в котором описано более десяти полиморфных сайтов. Установлено, что некоторые из полиморфизмов оказывают влияние на уровень продукции TGFβ1 in vitro [14]. Многие исследования показали ассоциацию отдельных полиморфизмов гена TGFβ1, не только с пониженной [13] или повышенной костной массой [12], но и с различными заболеваниями [7, 10].
Поскольку в нашей стране и за рубежом молекулярно-генетическим исследованиям больных травматолого-ортопедического профиля не уделено должного внимания, изучение генетического полиморфизма цитокинов, принимающих участие в механизмах регуляции межклеточных взаимодействий у больных при травме, а также поиски генетических маркеров развития осложнений представляются актуальными как с теоретической, так и с практической точки зрения.
Цель исследования – изучить влияние полиморфизма гена TGFβ1-25Arg>Pro на экспрессию TGFβ1 у больных с нарушением консолидации переломов в Забайкальском крае.
Материалы и методы исследования
В работе с обследуемыми лицами соблюдались этические принципы, предъявляемые Хельсинкской Декларацией Всемирной Медицинской Ассоциации (World Medical Association Declaration of Helsinki 1964, 2011 – поправки) и «Правилами клинической практики в Российской Федерации», утверждёнными Приказом Минздрава РФ от 19.06.2003 г. № 266. Проведено обследование 108 пациентов в возрасте от 20 до 40 лет с переломами длинных костей конечностей, лечившихся в травматологических стационарах г. Читы. Первую группу составили 62 пациента с неосложнённым течением переломов (группа клинического сравнения), вторую группу – 46 больных с осложнённым течением (в позднем послеоперационном периоде зарегистрировано нарушение консолидации переломов по типу замедленной консолидации). Контрольную группу составили 100 практически здоровых мужчин и женщин в возрасте от 20 до 40 лет.
Всем пациентам с закрытыми переломами проводилась открытая репозиция отломков с последующим металлоостеосинтезом пластинами или штифтами. Больным с открытыми переломами при поступлении выполнялась первичная хирургическая обработка и наложение аппаратов наружной фиксации. В дальнейшем применялась традиционная консервативная терапия (антибактериальные средства, дезагреганты, местное медикаментозное лечение и др.). Сформированные группы являлись относительно однородными как по возрасту, полу, характеру и локализации переломов, так и по проводимому лечению. Критерием исключения из групп являлось наличие острых или хронических сопутствующих заболеваний.
Материалом для молекулярно-генетического анализа служили образцы ДНК, выделенные из периферической венозной крови. Для исследования выбрана точковая мутация TGFβ1 в позиции 25 (Arg>Pro). Амплификацию фрагмента исследуемого гена проводили в термоцикле (модель Ре «Бис» – М111 (ООО «Бис-Н», Новосибирск). В работе использовались стандартные наборы праймеров научно-производственной фирмы «Литех»-«SNP» (Москва). Визуализация продуктов амплификации выполнена с помощью электрофореза в 3 % агарозном геле с добавлением бромистого этидия в проходящем ультрафиолетовом свете [9]. Определение концентрации цитокина TGFβ1 осуществляли с помощью набора реагентов ООО «Вектор-Бест» (г. Новосибирск).
Забор материала (венозная кровь) для лабораторного исследования осуществлялся на 10 сутки после травмы. Сроки наблюдения за больными составили: при поступлении в стационар (1 сутки после травмы), 10 сутки после оперативного лечения, в дальнейшем через 3 месяца.
Полученные данные обработаны с помощью пакета программ «STATISTICA 6.1» (Stat Soft, USA), «Microsoft Office Exell 2010 for Windows 7», «БИОСТАТ». Для описания характера распределения количественных признаков определялись средние величины (М), стандартные отклонения (SD). Для сравнения показателей пациентов с осложнённым и неосложнённым течением переломов длинных костей конечностей использовали критерий Манна-Уитни. Для анализа групп по качественному бинарному признаку применялся критерий χ2. Различия считались статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение
Первым этапом нами выявлена частота распределения аллелей и генотипов полиморфного гена TGFβ1-25Arg>Pro в исследуемых группах (табл. 1) [8].
Таблица 1
Частота генотипов гена TGFβ1-25Arg>Pro и его аллельных вариантов среди здоровых резидентов и пациентов с переломами костей конечностей (χ2, df = 1)
|
Контроль, n = 100 |
Неосложненное течение, n = 62 |
Замедленная консолидация, n = 46 |
|
|
Аллель Arg |
0,74 |
0,77 |
0,38*/** |
|
Аллель Pro |
0,26 |
0,23 |
0,62*/** |
|
Генотип ArgArg |
0,6 |
0,58 |
0,28*/** |
|
Генотип ArgPro |
0,28 |
0,37 |
0,2*/** |
|
Генотип ProPro |
0,12 |
0,05 |
0,52*/** |
Примечание.* – статистическая значимость различий с контролем; ** – статистическая значимость различий между I и II группой.
В группе с нарушением консолидации на долю гомозиготного генотипа -25Arg/Arg гена TGFβ1 приходилось 28,26 %, тогда как в группе с неосложнённым течением – 58,1 %. Генотип -25Arg/Pro гена TGFβ1 встречался в 19,57 % у пациентов второй группы против 37,1 % в первой. В группе с развитием замедленной консолидации выявлено 24 (52,17 %) пациента с гомозиготной мутацией, тогда как в группе клинического сравнения только 3 (4,8 %). Частота аллеля -27Arg- гена TGFβ1 у больных группы с неосложнённым течением переломов составила 0,77, аллеля -27Pro- – 0,23, а в группе с нарушением консолидации – 0,38 и 0,62 соответственно (р = 0,0001). В группе контроля носительство генотипов и его аллельных вариантов не отличалось от аналогичных параметров группы клинического сравнения (табл. 1) [8].
Прежде чем определить влияние генотипов исследуемого полиморфизма гена TGFβ1 на экспрессию TGFβ1, нами проведено изучение общего содержания ростового фактора TGFβ1 на 10-е сутки после травмы (табл. 2).
Таблица 2
Содержание TGFβ1 у больных с неосложнённым течением переломов длинных костей конечностей и нарушением консолидации на 10-е сутки после травмы, пг/мл (M ± SD)
|
Контроль (n = 100) |
I группа (n = 62) |
II группа (n = 46) |
|
|
TGFβ1 |
74,37 ± 28,8 |
121,2 ± 30,4 р = 0,0001 |
92,07 ± 31,2 р = 0,0001 р1 = 0,0001 |
Примечание. р – статистическая значимость различий с контролем; р1 – статистическая значимость различий с группой клинического сравнения.
Количественные показатели TGFβ1 у пациентов с неосложненным течением и нарушением консолидации превышали аналогичные значения в контрольной группе в 1,6 и 1,2 раза соответственно, что является закономерным и говорит о сохранении воспалительного ответа в зоне повреждения вследствие продолжающихся регенераторных процессов в костной ткани [4]. Однако у больных с нарушением консолидации регистрировалось снижение данного параметра в 1,3 раза по сопоставлению с группой клинического сравнения, что подтверждает ведущую роль исследуемых белков в процессах регенерации тканей и свидетельствует о нарушении консолидации перелома [4].
Третьим этапом работы мы установили влияние генотипов полиморфизма гена TGFβ1-25Arg>Pro на уровень продукции кодируемого цитокина (рисунок).
В группе с неосложнённым течением переломов у обладателей генотипа -25Arg/Arg гена TGFβ1 содержание TGFβ1 на 10 сутки посттравматического периода регистрируется на цифрах – 141,2 ± 20,12 пг/мл, что в 1,5 раза выше, по сравнению с группой контроля (р < 0,0001). У носителей гетерозиготного варианта -25Arg/Pro уровень TGFβ1 снижался относительно генотипа -25Arg/Arg в 1,5 раза и превышал аналогичное значение группы контроля в 1,7 раза. Что касается носительства мутантных гомозиготных вариантов в данной группе, то выявлено, что генотип -25Pro/Pro регистрировался в трех случаях, причем концентрация кодируемого белка находилась ниже уровня генотипа -25Arg/Arg и -25Arg/Pro в 2,1 и 1,4 раза соответственно, р < 0,0001. Аналогичная картина синтеза ростового фактора TGF-β1 при гомозиготной мутации зафиксирована как в группе пациентов с развитием замедленной консолидации переломов, так и в группе практически здоровых лиц (рисунок).
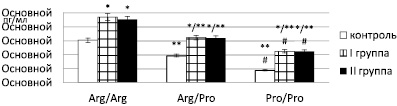
Содержание TGF-β1 на 10-е сутки в крови у травмированных больных в зависимости от генотипа полиморфизма гена TGFβ1-25Arg>Pro. Примечание: * – статистическая значимость различий с контролем; ** – статистическая значимость различий с нормальной гомозиготой; # – статистическая значимость различий с гетерозиготой (достоверно при р < 0,05)
Таким образом, полученные данные показывают, что наличие генотипа -25Pro/Pro полиморфизма гена TGFβ1-25Arg>Pro способствует значимому снижению экспрессии цитокина TGFβ1 при переломах длинных костей конечностей, что в свою очередь приводит к дисбалансу процессов ремоделирования костной ткани и нарушению консолидации переломов [4, 15]. Однако, исходя из данных о роли TGFβ1, можно предположить, что в зависимости от совокупности других факторов, неблагоприятным может оказаться как низкий, так и высокий уровень TGFβ1, и соответственно носительство альтернативных аллелей полиморфных участков гена, влияющих на уровень продукции белка [5].
Функциональная значимость полиморфизма гена TGFβ1 в работах разных исследователей неоднозначна, что, по-видимому, обусловлено природой патогенеза заболевания, особенностями клеточных линий, стимуляторов и другими условиями эксперимента [5].
У пациентов с нарушением консолидации переломов наиболее часто встречается гомозиготный генотип мутаций (-25Pro/Pro), что повышает вероятность развития нарушения регенераторных процессов при переломах. Данный факт указывает на важный вклад аллельного полиморфизма генов цитокинов в индивидуальные различия больных по характеру течения репаративной регенерации [8] вследствие разной экспрессии кодируемого цитокина [5]. В рамках рассматриваемой проблемы идентификация генов, вовлеченных в патогенез нарушения консолидации, является важной задачей, решение которой способствует формированию фундаментальных представлений о патогенезе данного социально значимого осложнения, что в конечном итоге позволит сделать долгосрочный индивидуальный прогноз для конкретного лица и провести необходимые профилактические мероприятия для его предотвращения.
Выводы
1. У больных с нарушением консолидации переломов регистрируется более высокое носительство генотипа -25Pro/Pro гена TGFβ1.
2. Наличие генотипа -25Pro/Pro полиморфизма гена TGFβ1 у больных с переломами длинных костей конечностей способствует более низкой экспрессии ростового фактора TGFβ1.
Рецензенты:
Лобанов С.Л., д.м.н., профессор, заведующий кафедрой факультетской хирургии с курсом урологии, ГБОУ ВПО «Читинская государственная медицинская академия» Минздрава России, г. Чита;
Цыбиков Н.Н., д.м.н., профессор, заведующий кафедрой патологической физиологии, ГБОУ ВПО «Читинская государственная медицинская академия» Минздрава России, г. Чита.



