Обращенно-фазовая высокоэффективная жидкостная хроматография (ВЭЖХ) является основным методом определения содержания лекарственных препаратов в биологических жидкостях человека, в частности для терапевтического мониторинга транквилизаторов, нейролептиков и антидепрессантов. Применение обычных обращенно-фазовых сорбентов (ОФС) для прямого, без отделения биологических макромолекул, ВЭЖХ-анализа биологических жидкостей невозможно из-за необратимой адсорбции белков на поверхности гидрофобизованных силикагелей [7]. Поэтому для определения лекарственных препаратов требуется предварительное удаление белков из анализируемых проб, что, как правило, является трудоёмкой операцией, существенно повышающей стоимость анализа и увеличивающей его продолжительность в два-пять раз. Ускорение такого анализа возможно за счёт использования различных видов автоматизированной проточной твердофазной микроэкстракции [7] или эксклюзионной хроматографии [6].
Более простым и эффективным методом преодоления указанных трудностей является использование гетероповерхностных сорбентов (ГС) вместо традиционных ОФС. Гетероповерхностные сорбенты получают адсорбционным насыщением поверхности гидрофобного сорбента на основе силикагеля со специально подобранной пористой структурой макромолекулами альбумина, которые затем дополнительно «сшивают» друг с другом [2, 4, 9]. Такая структура поверхностного слоя ГС обеспечивает эксклюзию биологических макромолекул из пробы без разделения и со скоростью, сопоставимой со скоростью подвижной фазы, тогда как для остальных низкомолекулярных компонентов пробы реализуют хроматографическое разделение по одному или нескольким механизмам удерживания. Это позволяет ограничить пробоподготовку простой фильтрацией пробы и осуществлять хроматографический анализ без удаления белков. Однако эффективность колонок с ГС всегда ниже, чем колонок, заполненных ОФС, на основе которого синтезирован ГС, так как защитное покрытие ГС замедляет диффузию низкомолекулярных компонентов проб в поры и из пор сорбента. Из-за того, что гидрофобность сшитых молекул альбумина меньше гидрофобности привитых алкильных групп, время удерживания лекарственных препаратов на ГС, как правило, немного меньше, чем на ОФС. Кроме того, при работе в кислых элюентах с pH ниже 4 протонированные аминогруппы глобул белка на внешней поверхности ГС способны поглощать отрицательно заряженные сорбаты [8]. При правильном выборе геометрических параметров кремнезёмных матриц для ГС доля поверхности, доступная для белковых компонентов проб, не превышает нескольких процентов, поэтому при её экранировании снижение гидрофобности у лучших образцов ГС невелико. Однако поглощение кислых сорбатов при низких pH элюента наблюдается и в этом случае, что делает невозможным их количественное определение.
Проблема определения кислых сорбатов может быть решена за счёт использования хроматографической системы с короткой колонкой, заполненной ГС, переключателя потоков подвижной фазы и стандартной колонки с ОФС. В этом случае при необходимости хроматографирования проб, содержащих кислые сорбаты, сильно кислыми элюентами, отделение белковых компонентов пробы на колонке с ГС производят при pH ˃ 4, а разделение на ОФС колонке – при требуемом значении pH, что позволяет избежать поглощения кислых сорбатов ГС. Использование системы, включающей короткую колонку с ГС вместе с ОФС по схеме «хроматографической лупы» вместо одной колонки с ГС позволяет повысить эффективность разделения целевых компонентов. Во многих случаях такая схема хроматографа позволяет избежать постепенного загрязнения ГС колонки компонентами из анализируемых проб, способных сорбироваться на белковом покрытии ГС, благодаря возможности регенерировать ГС колонки путем обратной промывки с помощью дополнительного насоса, производимой после перевода целевых компонентов на основную ОФС колонку [5].
Цель работы – оценка возможности использования колонки с гетероповерхностным сорбентом на основе алкилкремнезёма, экранированного сшитым альбумином, для прямого определения кофеина и теофиллина в плазме человеческой крови.
Материалы и методы исследования
В качестве матрицы для синтеза ГС использовали кремнезем, модифицированный алкилсиланом по стандартной методике [3]. Исходную кремнезёмную матрицу выбирали так, чтобы ОФС имел узкое распределение пор по размерам с максимумом распределения пор по диаметру около 6 нм. В данной работе использовали фракцию мезопористого силикагеля КСК-Г с размером частиц 5–7 мкм, распределение пор по размерам которого после модифицирования гексадецилдиметилхлорсиланом близко к оптимальному. В соответствии с методикой, изложенной в [4], и уточнениями [1], поверхность кремнезёма активировали, прививали гексаметилсилильные группы, экранировали внешнюю поверхность сорбента человеческим сывороточным альбумином (ЧСА), после чего глобулы ЧСА сшивали глутаровым альдегидом и восстанавливали азометиновые связи раствором боргидрида натрия. Полученный ГС упаковывали суспензионным способом в колонку из нержавеющей стали длиной 2 см и внутренним диаметром 4 мм. Для хроматографирования использовали градиентный насос Spectra Physics P4000, двухволновой сканирующий УФ-детектор UV2000 фирмы (Thermo Electron Corp., США) и петлевой кран-дозатор «Rheodyne-7125» с петлей объемом 25 мкл. Разделения проводили со скоростью потока подвижной фазы 1мл/мин, детектирование осуществляли на длине волны 254 нм.
ГС колонку подключали к двухпозиционному крану (рис. 1). В позиции «загрузка» (рис. 1, а) элюент от насоса проходил через первый кран-дозатор и ГС колонку, после которой направлялся в слив. При проведении анализа пробу вводили в систему с помощью петлевого крана-дозатора, белковые компоненты на выходе из колонки удаляли в слив, затем переключали кран из позиции «загрузка» в позицию «ввод» (рис. 1, б), направляя элюент с анализируемыми компонентами пробы на разделение из ГС колонки в аналитическую колонку. После выхода целевых компонентов из колонки её отключали обратным поворотом крана. При этом появлялась возможность промывки предколонки с помощью второго насоса. Схема обратной промывки ГС колонки показана на рис. 2.
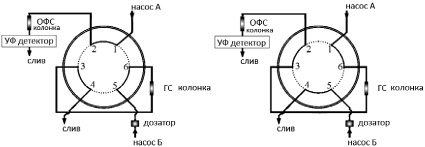
а б
Рис. 1. Схема организации потоков элюентов в режиме отделения белковых компонентов пробы (а) и при анализе целевых компонентов (б)
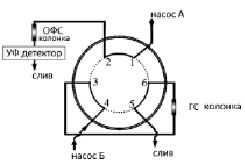
Рис. 2. Схема организации потоков элюентов в режиме обратной промывки ГС колонки
Для оценки инертности поверхности ГС к белкам пробы и определения времени удерживания целевых компонентов на колонке хроматографирование проводили через ГС колонку без ОФС колонки и использовали модельный раствор, приготовленный из физиологического раствора с добавлением человеческого сывороточного альбумина (ЧСА) до концентрации 10 мг/мл. Детектор подключали непосредственно к ГС колонке.
Модельный раствор вводили в ГС колонку порциями по 10 мкл. Хроматографические испытания проводили с использованием модельной смеси лекарственных препаратов, содержащей бензойную кислоту, теофиллин и кофеин в плазме крови. Фактор удерживания (коэффициент емкости) рассчитывали из отношения приведённого времени удерживания к мёртвому времени:
k = tR/tM.
Результаты исследования и их обсуждение
Для оценки качества модифицирования поверхности синтезированного ГС до упаковки в хроматографическую колонку была измерена адсорбционная ёмкость по ЧСА для трёх сорбентов, синтезированных на основе одного и того же кремнезёма КСК-Г. Для гетероповерхностного сорбента она составила 0,9 мг/г, для исходного ОФС – 24,5 мг/г и для сравнения для сорбента с привитыми диольными группами – 1,1 мг/г. Эти результаты подтверждают инертность доступной для белков проб поверхности ГС, близкую к инертности сорбента с диольными группами, специально синтезированного для разделения биополимеров. Преимуществом ГС при его использовании в колонках для анализа гидрофобных лекарственных препаратов является существенно больший в сравнении с гидрофильными сорбентами фактор удерживания анализируемых лекарственных веществ и высокая селективность, позволяющая эффективно отделять белки пробы.
При первоначальном использовании колонки с гетероповерхностным сорбентом наблюдали наличие небольшой сорбционной ёмкости по ЧСА, суммарно равной 50 мкг для колонки 20×4 мм, проявлявшееся в постепенном насыщении ГС колонки при повторных вводах 20 мкл модельного раствора. Размер хроматографического ЧСА на выходе из ГС колонки составлял 3 % при первого вводе, 14 % при втором и 74 % для третьего, а начиная с пятого ввода, процент обнаружения был более 97 %. Этот эффект наблюдался лишь при первом использовании и, вероятно, вызван незначительным повреждением защитного белкового слоя на поверхности сорбента при упаковке предколонки суспензионным методом.
Большое значение в условиях хроматографирования с прямым вводом анализируемых проб имеет стабильность защитного слоя ГС. Для оценки этого параметра использовали модельная смесь с содержанием теофиллина 2,7 мг/мл и кофеина 1,0 мг/мл в нефильтрованной плазме человеческой крови. Пробы вводили по 10 мкл. Хроматографирование осуществляли в изократическом режиме с использованием элюента 0,02 М гидроортофосфата натрия (pH = 6,0) – ацетонитрил (90:10). По мере ввода проб давление на входе в предколонку возрастало практически линейно вплоть до ввода 60-й пробы. Так, после первых 30 проб давление на входе в предколонку возросло на 50 %, при вводе следующих 30 проб оно удвоилось относительно первоначального. Далее давление возрастало медленнее, и после ввода 90 проб (50 мг в пересчёте на сухое вещество введённой нефильтрованной плазмы суммарно) превышало начальное в 2,25 раза. После обратной промывки ГС колонки метанолом давление снизилось до 120 % от первоначального. Характеристики удерживания кофеина и теофиллина практически не изменялись во время эксперимента. Фактор удерживания составил для теофиллина k = 4,0 ± 0,1 и для кофеина k = 8,5 ± 0,4.
Вероятно, повышение давления на входе в ГС колонку связано с адсорбцией белков пробы на входном фильтре, поэтому желательно производить предварительную фильтрацию плазмы крови перед её вводом в хроматографическую систему. Однако при использовании схемы с обратной промывкой допустимо использование нефильтрованной плазмы для анализа. В пересчёте на сухое вещество до регенерации ГС колонки можно суммарно ввести до 50 мг белков плазмы во всех образцах.
Полученные зависимости удерживания аналитов кислой и основной природы от pH, ионной силы и концентрации органического растворителя в элюенте подобны для ГС и ОФС [8]. Увеличение содержания ацетонитрила в элюенте 0,02 М фосфат натрия– ацетонитрил (pH = 6,5) от 10 до 15 % уменьшает факторы удерживания теофиллина и кофеина на ГС на треть; при дальнейшем увеличении содержания ацетонитрила до 20 % факторы удерживания практически не изменяются. Снижение концентрации ацетонитрила до 5 % увеличивает фактор удерживания теофиллина и кофеина в 2 и 3,3 раза соответственно вследствие усиливающегося неспецифического взаимодействия этих молекул с привитыми гексадецильными группами ГС. Таким образом, изменение концентрации ацетонитрила в элюенте позволяет оптимизировать время выхода целевых компонентов пробы и добиться их отделения от белковых компонентов за приемлемое время. При длительной эксплуатации ГС колонки с элюентом, содержащим менее 10 % ацетонитрила, необходимо предпринимать меры, предотвращающие биодеградацию защитного слоя гетероповерхностного сорбента. В то же время использование элюента с высоким содержанием (> 20 %) органического растворителя обеспечивает сохранность защитного слоя на поверхности ГС.
Для элюента натрийфосфатный буферный раствор (pH = 6,5) – ацетонитрил (90:10) варьирование концентрации фосфатов в буферном растворе от 0,02 до 0,2 М не влияет на удерживание бензойной кислоты, теофиллина и кофеина, что свидетельствует о незначительном вкладе ионообменных взаимодействий в удерживание молекул сорбатов ГС. Фактор удерживания для бензойной кислоты k = 1,4 ± 0,1; для теофиллина k = 3,2 ± 0,1 и для кофеина k = 7,3 ± 0,3.
Из-за полиамфолитной природы ЧСА варьирование pH элюента изменяет степень протонирования ионоогенных групп и влияет на ионообменные свойства ГС. При изменении pH элюента 0,02 М натрийфосфатный буферный раствор – ацетонитрил (95:5) в диапазоне от 3,0 до 6,0 удерживания теофиллина и кофеина, обладающих основной природой, незначительно увеличивается. Фактор удерживания для теофиллина k = 4,0 ± 0,2, для кофеина k = 9,1 ± 0,4. По мере повышения pH до 7,5 фактор удерживания теофиллина монотонно уменьшается вплоть до k = 2,7. Фактор удерживания кофеина при этом остаётся неизменным. Фактор удерживания бензойной кислоты в диапазоне pH от 7,5 до 5,0 постоянен (k = 1,3), при снижении pH до 4,5 он существенно увеличивается (k = 7,5), при pH = 4,5 возрастает ещё больше (k = 14), а при pH < 4 бензойная кислота полностью поглощается сорбентом из-за взаимодействия с протонированными аминогруппами ЧСА. Следовательно, элюенты с pH от 5,0 до 7,5 применимы для определения всех сорбатов, тогда как элюенты с pH < 4,0 непригодны для разделения веществ кислой природы на ГС колонке.
Выводы
Белки плазмы человеческой крови не удерживаются на гетероповерхностном сорбенте и элюируются одним пиком из ГС колонки до выхода низкомолекулярных лекарственных компонентов пробы. Время удерживания гидрофобных сорбатов на ГС несколько меньше, чем на ОФС. Сходство характеристик удерживания на гетероповерхностном сорбенте и на широко используемых гидрофобных сорбентах позволяет прогнозировать последовательность выхода и времена удерживания целевых компонентов и использовать отработанные методики после незначительной адаптации.
Несмотря на то, что лучше производить предварительную фильтрацию плазмы крови перед её вводом в хроматографическую систему, допустимо введение суммарно до 50 мг белков нефильтрованной плазмы при использовании схемы с обратной промывкой ГС колонки метанолом.
ГС позволяет использовать элюенты с различными концентрациями органического модификатора, однако при длительной эксплуатации ГС колонки в элюентах с низким (менее 10 %) содержанием ацетонитрила или метанола необходимо принимать меры против биодеградации сорбента.
Допустимый диапазон pH элюента составляет от 4,5 до 7,5. При меньших значениях на защитном покрытии ГС может наблюдаться поглощение кислых сорбатов. Для отделения теофиллина и кофеина от белковых компонентов пробы достаточно использования короткой колонки 20×4 мм с гетероповерхностным сорбентом.
Применение предколонки с ГС позволяет производить определение кофеина и теофиллина в плазме крови после её фильтрации, исключив нежелательные стадии предварительной подготовки пробы.
Рецензенты:
Лисичкин Г.В., д.х.н., главный научный сотрудник, профессор, зав. лабораторией химии поверхности кафедры химии нефти и органического катализа химического факультета, МГУ, г. Москва;
Рощина Т.М., д.х.н., профессор, лаборатория адсорбции и хроматографии кафедры физической химии химического факультета, МГУ, г. Москва.



