Широкий спектр биологической активности флавоноидных соединений обусловлен прежде всего их высокой антирадикальной активностью, благодаря чему в различных органах и тканях производит нормализация патохимических процессов. Растущая потребность в препаратах этой группы свидетельствует о необходимости поиска доступных и экономически выгодных сырьевых источников. С этой точки зрения целесообразно использование пищевых растений, в частности цитрусовых. В нашей стране кожура плодов цитрусовых практически не применяется, хотя она богата пектинами, витаминами и флавоноидами. Ранее нами из кожуры апельсинов была получена субстанция, характеризующаяся противоязвенной активностью[1, 2]. Максимальное содержание флавоноидов наблюдается в кожуре, причем большинство из них представлено гликозидами флаванонов. Помело (Citrus maxima, Citrus grandis) – растение рода Цитрус, богатое витаминами, эфирным маслом, толстая кожура и мякоть которого богаты микроэлементами, витаминами и эфирными маслами. Флавоноиды, содержащиеся в кожуре помело, эффективны при заболеваниях кишечника, поджелудочной железы, а также предотвращают распространение клеток рака молочной железы за счет снижения избытка эстрогена [3, 4, 5].
Целью нашего исследования является изучение состава флаванонов, а также разработка методики количественного определения флавоноидов в кожуре Citrus maxima.
Материалы и методы исследования
Сырьем является высушенная и измельченная кожура C. maxima. Качественный анализ проводили с помощью бумажной хроматографии в системах 15 % уксусная кислота и бутанол : уксусная кислота : вода (БУВ) (4:1:5); УФ-, ИК- и ЯМР 1Н–спектроскопии. В основу количественного определения положен спектрофотометрический метод, основанный на измерении оптической плотности флаванонов. В качестве стандартного образца использовали гесперидин.
Результаты исследования и их обсуждение
Первым этапом нашего исследования стал анализ качественного состава флаванонов методом бумажной хроматографии. Установлено, что спиртовой экстракт из кожуры помело содержит в своем составе преимущественно один флаванон со значением Rf 0,59 в системе БУВ 4:1:5 и Rf 0,89 в 15 % уксусной кислоте. Низкое значение Rf в системе БУВ 4:1:5 указывает, что вещество является либо дигликозидом, либо биозидом.
При последовательной обработке хроматографического пятна вещества последовательно 2 % раствором натрия боргидрида и парами концентрированной хлороводородной кислоты появляется характерное для флаванонов малиновое окрашивание, а в условиях цианидиновой реакции разбавленный этанолом экстракт окрашивается в фиолетовый цвет.
Далее проводили выделение индивидуального флаванона по разработанной ранее методике [1].
При количественном кислотном гидролизе выход агликона составляет 46,9 %, что характерно для дигликозидов. В гидролизате после нейтрализации хроматографически идентифицированы D-глюкоза и L-рамноза. Агликон – представляет желтые игольчатые кристаллы, хорошо растворимые в спирте, т.пл. 250 °С, Rf 0,90 (БУВ 4:1:5); в условиях цианидиновой реакции раствор его приобретает темно-красно-фиолетовую окраску. На БХ в УФ-свете пятно агликона имеет темную окраску, которая в парах аммиака приобретает светло-голубую флуоресценцию, а с боргидридом натрия и концентрированной соляной кислотой – розовую окраску. УФ-спектр характеризуется двумя полосами поглощения – высокоинтенсивная коротковолновая полоса с максимумом при 290 и слабоинтенсивная широкая размытая полоса в длинноволновой зоне с максимумом при 325 нм.
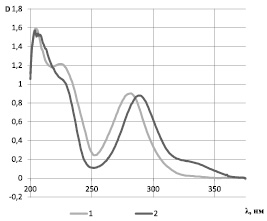
Рис. 1. УФ-спектр нарингина – 1 и его агликона – 2
В ИК-спектре агликона имеются полосы поглощения при 1600, 1560 см–1, соответствующие валентным колебаниям –С = С ароматической системы, полосы 1350, 1260 – валентным колебаниям С-О, 1175, 3370 см–1 – валентным колебаниям фенольной–ОН, 1035, 910, 835 см–1 полосы деформационных колебаниий –С–H– замещенного бензольного кольца и 1640 см–1 – валентным колебаниям С = О g-пирона, 3400–3300 см–1 – валентным колебаниям гидроксигрупп (рис. 2).
В ЯМР-спектре агликона (ДМСО, d, м.д.) характерно отсутствие сигналов протонов ОН углеводных остатков, наблюдали сигналы: 5,44 (dd Н-2); 2,83 (dd Н-3ax); 3,21 (dd Н-3eq); 5,45 (s Н-8); 5,87 (s Н-6); 7,29 (d Н-2′); 6,77 (d Н-3′); 6,79 (d Н-5′); 7,32 (d Н-6′), 12,13 (s 5-ОН); 10,77 (s 7-ОН); 9,58 (s 4′-ОН).
Таким образом на основании данных количественного кислотного гидролиза, УФ-, ИК- и ЯМР 1Н–спектроскопии, температуры плавления агликон идентифицирован как 5,7,41-тригидроксифлаванон (нарингенин).
В основу количественного исследования положен спектрофотометрический метод, основанный на измерении оптической плотности флаванонов. В качестве стандартного образца использовали гесперидин, поскольку данный флаванон-биозид содержится практически во всех представителях рода Citrus.
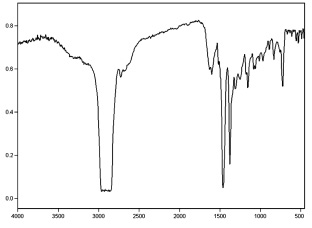
Рис. 2. ИК-спектр агликона
Методика количественного определения. Аналитическую пробу сырья измельчают до размера частиц, проходящих сквозь сито с диаметром отверстий 2 мм. Около 1,0 (очная навеска) помещают в колбу со шлифом вместимостью 100 мл, прибавляют 30 мл этанола, к колбе подсоединяют обратный холодильник и нагревают на кипящей водяной бане в течение 30 мин. Далее смесь охлаждают до комнатной температуры, фильтруют через бумажный фильтр в мерную колбу емкостью 100 мл. Извлечение вышеуказанным способом повторяют 3 раза и доводят объем фильтрата до метки этанолом. 1 мл полученного извлечения переносят в мерную колбу емкостью 25 мл и доводят объем до метки. Измеряют оптическую плотность раствора на спектрофотометре при длине волны 286 нм в кювете с толщиной слоя 10 мм.
Для построения калибровочного графика зависимости оптической плотности от количества гесперидина в растворе точную навеску 0,01 г этого вещества количественно переносят в мерную колбу вместимостью 50 мл, прибавляют этанол до растворения вещества, затем объем раствора доводят до метки.
Для приготовления разведений в мерные колбы на 25 мл переносят аликвоты раствора стандарта и доводят до метки этанолом. Используют аликвоты раствора стандарта, мл: 0,6; 1,0; 1,4; 1,8; 2,2; 2,6; 3,0; 3,4; 3,8. При этом количество гесперидина в 25 мл спектрофотометрируемого раствора равно соответственно г·10–5: 0,48; 0,80; 1,12; 1,296; 1,76; 2,08; 2,40; 2,72; 3,04.
Оптическую плотность измеряют при длине волны 286 нм в кювете с толщиной поглощающего слоя 1 см; в рабочую кювету помещают анализируемые растворы, в кювету сравнения – этанол. Калибровочный график зависимости оптической плотности (D) от количества гесперидина в спектрофотометрируемом растворе (с) имеет вид прямой линии.
Массовую долю суммы флавоноидов в исследуемых экстрактах в пересчете на гесперидин вычисляют по формуле:
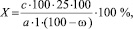
где с – количество гесперидина в анализируемой аликвоте экстракта, соответствующее измеренной оптической плотности по калибровочному графику, с·10–5 г/мл; a – масса сырья, г; ω – потеря в массе сырья при высушивании, %.
Выводы
- Из кожуры C. maxima выделен флаванон нарингин, установлена его структура с использованием современных физико-химических методов.
- Разработана методика количественного определения содержания флавоноидов в кожуре C. maxima.
- Количественное содержание флавоноидов в экстрактах из кожуры C. maxima (помело) в пересчете на гесперидин составляет 6,59 ± 0,1217 %.
Количественное содержание суммы флавоноидов в кожуре C. maxima
|
Содержание суммы флавоноидов в пересчете на гесперидин, % |
Метрологические характеристики |
|
|
1 |
6,5012 |
Хср = 6,59 S = 0,1160 Sхср = 0,0473 DХ = 0,1217 Х ± DХ = 6,59 ± 0,1217 e = 1,85 % |
|
2 |
6,6332 |
|
|
3 |
6,7745 |
|
|
4 |
6,5167 |
|
|
5 |
6,6385 |
|
|
6 |
6,4645 |
Рецензенты:
Кодониди И.П., д.фарм.н., доцент кафедры органической химии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград;
Попова О.И., д.фарм.н., профессор кафедры фармакогнозии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Волгоград.
Работа поступила в редакцию 04.04.2014.
Библиографическая ссылка
Евсеева О.С., Андреева О.А., Оганесян Э.Т., Ароян М.В. О КАЧЕСТВЕННОМ СОСТАВЕ ФЛАВАНОНОВ И ИХ КОЛИЧЕСТВЕННОМ СОДЕРЖАНИИ В КОЖУРЕ CITRUS MAXIMA // Фундаментальные исследования. 2014. № 6-1. С. 96-99;URL: https://fundamental-research.ru/ru/article/view?id=34117 (дата обращения: 07.02.2026).



