Усовершенствование существующих методов исследования, включая возможность определения иммуногистохимических маркеров синцитиотрофобласта, позволяет значительно увеличить точность определения последовательности и сущности событий, происходящих в период имплантации и ранних стадий плацентации. В литературе содержится немного информации о чёткой дифференциации процессов, вовлечённых в морфогенез плаценты [6, 2]. Обнаружение в сыворотке крови беременной женщины некоторых продуктов синтеза плацентарой ткани (плацентарной щелочной фосфатаза, далее - PLAP, фактора роста эндотелия сосудов - VEGF, человеческого хорионического гонадотропина, далее - β-HGCH) и других веществ, освобождаемых в результате апоптоза клеток плода, делает возможным использование их в качестве биомаркеров нарушений развития фето-плацентарного комплекса [7, 13, 3]. По данным ряда авторов, иммуногистохимический анализ позволяет определить некоторые плодные белки, PLAP или её ферментативную активность и указывает на увеличение концентрации маркеров синцитиотрофобласта в плазме крови у женщин с ранним началом преэклампсии по сравнению с нормальными показателями беременных женщин [8]. В отличие от более поздних стадий развития беременности обнаружение маркеров синцитиотрофобласта и эмбриональных клеток возможно уже на 5-й неделе беременности [4], что коррелирует с такими осложнениями беременности, как угроза невынашивания, многоводие, ранний токсикоз, анеуплоидия и преэклампсия [10, 14, 15]. Таким образом, определение сроков начала и динамики развития экспрессии маркеров синцитиотрофобласта является важным как при физиологической беременности, так и в установлении причин нарушений её развития или невынашивания.
Целью исследования является установление сроков начала и динамики иммуногистохимической экспрессии некоторых маркеров синцитиотрофобласта в условиях физиологической беременности.
Материал и методы исследования
Плацентарная ткань для исследований была получена при процедуре проведения медицинских абортов на сроках гестации от 5,5 до 10,5 недель развития. Срок гестации определялся по 1-у дню последней менструации. Для уточнения сроков гестации дополнительно использовали данные о результатах ультрасонографии матки с определением теменно-копчикового размера эмбриона по номограмме сонографа перед началом прерывания беременности. Средний возраст матери составил 26,1 ± 1,3 лет, все пациентки были соматически здоровы. Полученную плацентарную ткань тщательно промывали дистиллированной холодной водой с инструментальным выделением фрагментов хориального слоя плаценты и ворсин. Эмбриональная ткань исключалась из исследования. Полученные таким образом фрагменты плацентарной ткани фиксировались в 10 %-м нейтральном буферном растворе формалина 24-48 часов и обрабатывали по стандартной гистологической технике. Срезы толщиной 3-5 микрон окрашивали гематоксилином-эозином. Кроме того, после депарафинизации на тонких срезах выявляли экспрессию рецепторов к человеческому хорионическому β-гонадотропному гормону - β-HCG; к рецепторам 3 типа сосудистого эндотелиального фактора роста - VEGFR-3; плацентарную щелочную фосфатазу - PLAP. После депарафинизации и нанесения первичных антител маркёры выявлялись с помощью Universal iSH Detection Kit. Для этого депарафинированные в ксилоле срезы регидрататировали через спирты снижающейся концентрации и выдерживали в 1 %-м растворе перекиси водорода и метанола в течение 10 минут, для погашения активности эндогенной пероксидазы. Далее срезы промывали в 0,15 М трис-буфере. Маркёры были детектированы с помощью пероксидаза-авидин-биотинового метода. Конечный продукт реакции определяли с помошью 3,3'-диаминобензидина (DAB, Sigma Chemical Co), содержащего 0,01 % перекиси водорода в течение 2-3 мин. Срезы контрастировали гематоксилином Майера в течение 30 с, дегидратировали, просветляли в ксилоле. Постоянный положительный и отрицательный контроли были включены в каждую серию исследования. Препараты исследовали и фотодокументировали под световым микроскопом Leica DM500 и Leica DM4000 c использованием системы Leica Application Suite и цифровой фотокамеры высокого разрешения.
Интенсивность экспрессии рецепторов определяли стандартным полуколичественным методом с учётом интенсивности окрашивания (0 - негативная реакция; 1 - признаки иммуноэкспрессии в виде слабого окрашивания цитоплазмы клеток; 2 - умеренно выраженная (несомненная) экспрессия; 3 - максимальные экспрессия и значения процента положительных клеток. Гистохимический коэффициент определяли по соответствующей формуле HS (Histochemical score) = ∑ P(i)хi, в которой i - интенсивность окрашивания, выраженная в баллах от 0 до 3-х, P(i) - процент клеток, окрашенных с разной интенсивностью. Результат подсчёта НS счет трактовали следующим образом: от 0 до 10 - отрицательный; от 10 до 100 - слабоположительный; от 100 до 300 - положительный. Статистический анализ полученных результатов производили с использованием лицензионной программы «Statistica 6.0» фирмы StatSoft Inc. (USA) с использованием параметрической и непараметрической статистики.
Результаты исследования и их обсуждение
Наиболее значимым показателем развития ворсин хориона является степень их васкуляризации, которая была нами исследована с помощью реакции к рецепторам VEGFR-3, избирательно экспрессирующимся в ангиобластах и эндотелиоцитах. На 5-й неделе гестации наблюдалась одновременная иммуноэкспрессия этого маркера в эндотелии капилляров эндометрия и ворсинах плаценты. По мере увеличения срока гестации происходит укрупнение капилляров и плотности их распределения с ориентацией новообразованной капиллярной сети в сторону эпителия ворсин на 6-й неделе и особенно выраженное на 7-й неделе (рис. 1, «A-D»). Подобные картины субэпителиального расположения примитивной капиллярной сети наблюдались и на 8-й неделе, что отражает, структурную готовность капилляров для предстоящего интенсивного гемохориального обмена (рис. 1, «E-F»). Гистохимический коэффициент экспрессии рецепторов VEGFR-3 статистически значимо растёт в течение эмбрионального периода развития от 210,0 ± 62,5 до 235,5 ± 53,8 баллов, составляя в среднем 223,1 ± 58,9 балла (таблица). Линейная корреляция этого маркёра с возрастом оказалась незначимой ввиду несоответствия формы распределения данных нормальной.
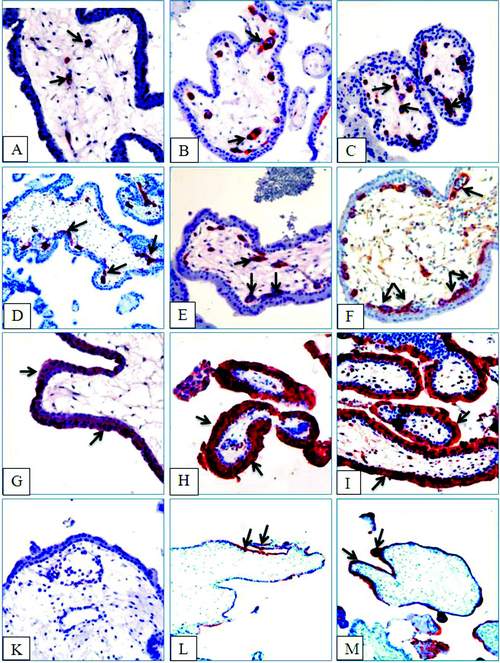
Рис. 1. Микрофото препаратов плаценты человека. Иммуногистохимическая экспрессия маркеров синцитиотрофобласта ворсин в виде продукта реакции красного цвета (указано стрелками), ув. х200. Экспрессия VEGFR-3 на 5-6 неделе гестации: A-B - васкулогенез в виде аутохтонно возникающих островков и небольших тяжей ангиобластов; C - ангиобласты и первичные капилляры; D - начало ангиогенеза в виде встречных тяжей ангиобластов между сформированными изолированными капиллярами. Экспрессия VEGFR-3 на 7-8 неделе гестации: E-F - сформированная первичная капиллярная сеть. Экспрессия β-ХГЧ на 6-7 неделе гестации: G-I - высокая активность маркера в апикальной зоне синцитиотрофобласта хориальных ворсин при негативной реакции в клетках цитотрофобласта. Экспрессия PLAP: K - отсутствие экспрессии маркера на 6-7 неделе; L-M (ув. х100) - экспрессия маркёра на 8-9 неделе в зоне щёточной каймы синцитиотрофобласта
Как правило, эмбриональные биоматериалы по подавляющему большинству количественных и качественных измеряемых параметров всегда имеют значительный разброс индивидуальных величин показателей. В связи с особенностями биоматериала и небольшим объёмом исследуемой выборки нами предварительно были осуществлены процедуры проверки выпадов (артефактов) по методу, предложенному Плохинским (1970), и на соответствие распределения значений нормальному по критерию Шапиро-Уилка.
Показатели иммуногистохимической экспрессии маркёров синцитиотрофобласта плаценты человека 5-10,5 недель гестации в баллах (M ± σ)
|
№ п/п |
ИГХ-маркёр |
Возраст эмбриона или плода в неделях гестации |
*Уровень достоверности различий по t-критерию Стъюдента |
*Уровень достоверности различий по критерию Колмогорова-Смирнова или Вальда-Вольфовица |
||
|
5-7 (n = 19) |
7,5-10,5 (n = 20) |
5-10,5 (n = 39) |
||||
|
1 |
PLAP |
0,00 ± 0,00* |
23,5 ± 32,97* |
12,05 ± 26,2 |
0,003643 |
0,003244 |
|
2 |
VEGFR-3 |
210,0 ± 62,5* |
235,5 ± 53,8* |
223,1 ± 58,9 |
0,179953 |
< 0,05 |
|
3 |
β-HCGH |
270,5 ± 39,6* |
265,0 ± 51,9* |
267,7 ± 45,8 |
0,712071 |
0,008408 |
Из всех анализируемых групп значений только значения VEGFR-3 для гестационного возраста 7,5-10,5 недель имели нормальное распределение (значения критерия W = 0,91318 при p = 0,07331). Все остальные анализируемые группы имели распределение, статистически значимо отличающееся от нормального. При сравнении и поиске различий между возрастными группами 5-7 и 7,5-10,5 недель развития были использованы как параметрические, так и непараметрические критерии различий (см. таблицу). Иммуноэкспрессия плацентарной щелочной фосфатазы составила в среднем 12,05 ± 26,2 баллов за исследованный период гестации и отчётливо выявлялась только после 7,5 недель (23,5 ± 32,97 баллов). Коэффициент линейной корреляции Пирсона этого маркёра с возрастом был статистически значимым, его значение было положительным и составило (r ± mr) = 0,45 ± 0,15, непараметрическая ранговая корреляция Спирмена также для этого показателя была статистически значима и имела более высокое значение rS = 0,661 (p < 0,05). Наличие статистически значимой линейной корреляции позволило построить график множественной регрессии показателя PLAP от гестационного возраста. Скорректированный коэффициент регрессии составил PLAP-R2 = 0,50394847 (p = 0,00000), уравнение множественной линейной регрессии выглядит следующим образом:
HS PLAP = 11,4·G - 72,9,
в котором «G» - возраст эмбриона или плода в неделях гестации. С учётом выраженной возрастной неравномерности экспрессии PLAP нами был осуществлён подбор её зависимости от возраста графическим способом в рамках опций программы Statistica. Наилучшим графическим отражением зависимости оказался полиномиальный график, соответствующее уравнение имело следующий вид:
HS PLAP = 243,2 - 74,6·G + 5,6·G2 (рис. 2).
Для маркёров VEGFR-3 и β-HCGH значения соответствующих скорректированных коэффициентов регрессии было недостоверным и составило VEGFR-3-R2 = 0,03702769 (p = 0,125207) и β-HCGH-R2 = 0,00091143 (p = 0,332212), соответственно. При обзорном анализе микропрепаратов указанные выше количественные закономерности иммуноэкспрессии PLAP также нашли отражение. Тщательные поиски не выявили присутствия этого фермента в тканях плаценты на 5-6 неделях гестации (рис. 1, «К»).
Лишь на 7-й неделе изначально она выявлялась в синцитиальных почках и в отдельных участках покровного эпителия ворсин. На 8-й неделе иммуноэкспрессия PLAP определялась по всему периметру эпителия ворсин, в отдельных участках она явно концентрировалась в апикальной части синцитиотрофобласта, т.е. в зоне щёточной каймы (рис. 1, «L-M»).
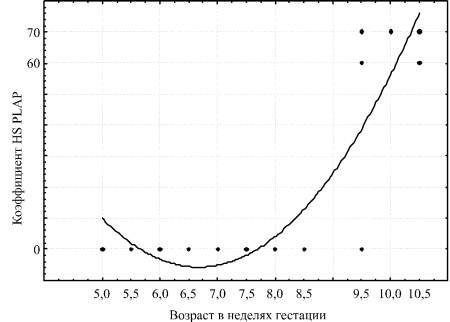
Рис. 2. Диаграмма полиномиальной зависимости значений гистохимического коэффициента экспрессии PLAP от возраста эмбриона или плода в неделях гестации
Отсутствие в настоящее время единого понимания начала и становления механизма эмбриохориального кровообращения не исключает по меньшей мере двух наиболее приемлемых точек зрения о его возникновении и развитии. Первая заключается в миграции эндоваскулярных трофобластов по децидуальным спиральным артериям, по путям, ведущим в межворсинчатое пространство к материнской крови [5, 11]. Согласно второй точке зрения трофобласты врастают в децидуальные спиральные артерии и образуют трофобластические пробки, которые блокируют кровоток матери в межворсинчатом пространстве и предотвращают его вплоть до конца первого триместра (10-12 недель гестации) [9]. Ворсинчатый трофобласт содержит две популяции клеток: недифференцированные цитотрофобластические и полностью дифференцированные синцитиотрофобластические, которые управляют сложными бимолекулярными взаимодействиями и в качестве важного эндокринного органа производят многочисленные факторы роста, регулируя процессы развития и роста плаценты и плода. VEGF является чрезвычайно специфичным митогеном эндотелиальных клеток, который стимулирует эндотелиальную пролиферацию, миграцию клеток и замедляет апоптоз. Demir c соавт. [6] выявили, что клетки Гофбауэра часто обнаруживаются в непосредственной близости от цитотрофобласта, васкулогенных и ангиогенных клеток-предшественников ворсинчатой ткани. Эти факты наводят на мысль о том, что они задействованы в процессах сопровождения и формирования ангиогенных клеток во время развития ворсинчатого остова. Обнаруженные нами рецепторы к β-HCG подтверждают данные литературы о том, что его выработка достигает самого высокого уровня в 8 недель, а затем постепенно падает. Плацентарную щелочную фосфатазу, источником которой в организме матери является плацента, относят к белкам, ассоциированным с беременностью и опухолевым ростом. В онтогенезе его экспрессия регулируется таким образом, что до 10-й недели беременности в плаценте присутствует фосфатаза, похожая по свойствам на печеночную взрослого человека, на 10-13 неделях удаётся обнаружить плацентарный изоэнзим, а к 14 неделям этот фермент обнаруживает полную активность, причём синтез его стимулируется эстрогенами [1]. Функция PLAP в организме матери представляется неоднозначной. По-видимому, этот энзим, участвуя в дефосфорилировании различных соединений, является активным ключевым ферментом многих метаболических процессов в быстрорастущих тканях матери и плода, для обеспечения которых обычных гидролаз было бы недостаточно [12]. Кроме того, PLAP принимает участие в активации факторов роста и, возможно, сама обладает такими свойствами. Есть также указания на то, что она может играть роль активатора плазминогена, что очень важно для регуляции системы гемостаза плаценты и плацентарного ложа. В условиях физиологической беременности PLAP, наряду с β-HCG, плацентарным лактогеном, специфическим бета-гликопротеином беременных и антигеном KI67, относится к маркёрам дифференцировки трофобласта, поэтому она может быть надёжным индикатором срока гестации и развития плаценты [12].
Выводы
Таким образом, согласно полученным результатам, сроками начала экспрессии рецепторов к ранним маркёрам, отражающим процессы физиологического морфогенеза плаценты, β-HCG и VEGF-3 следует считать 5 неделю гестации. PLAP в щёточной кайме синцитиотрофобласта при физиологической беременности начинает выявляться с 7 недели гестации. Начало интенсивной гормонопродуцирующей функции синцитиотрофобласта синхронизировано с началом васкуляризации ворсин и интенсивным ангиогенезом, формированием полноценной капиллярной сети и приближением её к эпителиальному покрову. Эти иммуногистохимические находки свидетельствуют о последовательности процессов структурной перестройки ворсин хориона для подготовки их к гемохориальному обмену. Количественные показатели исследованных нами плацентарных маркеров могут быть использованы в качестве исходных критериев патоморфологической диагностики при патологии ранней беременности, установления причин невынашивания и самопроизвольного прерывания.
Авторы заявляют об отсутствии каких бы то ни было конфликтов интересов с кем бы то ни было в отношении идеи, планирования, выполнения и опубликования результатов настоящего исследования и их последующего использования в коммерческих или иных целях.
Рецензенты:
Чарышкин А.Л., д.м.н., профессор, заведующий кафедрой факультетской хирургии ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Музурова Л.В., д.м.н., профессор кафедры анатомии человека ГОУ ВПО «Саратовский ГМУ имени В.И. Разумовского», г. Саратов.
Работа поступила в редакцию 15.11.2012.



