Ревматоидный артрит (РА) – это хроническое системное прогрессирующее аутоиммунное воспалительное заболевание [12], характеризующееся нарушением клеточного иммунитета и формированием гиперплазии синовии в результате интенсивной инфильтрации воспалительными клетками. Воспалительные клетки состоят преимущественно из макрофагов и лимфоцитов, а также представлены ростом резидентных клеток (синовиальных фибробластов) и обильным формированием новых сосудов в синовии [2, 7]. Эти процессы приводят к разрушению суставного хряща, субхондральной кости и связок (деструктивному полиартриту) [2, 9, 12], часто с тяжелыми последствиями, приводящими к нарушению трудоспособности [2].
РА вызван взаимодействием индивидуальной генетической предрасположенности, факторов внешней среды и нарушенного регулирования иммунных ответов [4]. При РА имеет место активация цитокиновой системы, увеличение уровня провоспалительных биомолекул цитокинов, в частности, интерлейкина-8 (ИЛ-8), привлекающего в синовий все известные типы мигрирующих иммунных клеток, что, вероятно, обусловливает повреждение суставных тканей, выраженность клинических проявлений и хроническое течение заболевания. Возникающее противодействие противовоспалительных молекул (например, ИЛ-4) не позволяет подавить запущенный воспалительный процесс.
Есть версия, что РА обусловлен действиями патогенных клеток Тх17 и Тх1. Развитие и секреция цитокинов Тх17 и Тх1 клетками угнетается противовоспалительным цитокином ИЛ-4, продуцируемым Тх2 [1, 3, 15]. ИЛ-4 секретируется также базофилами и тучными клетками [7]. Он обладает антиостеокластогенным эффектом [14] и проявляет противовоспалительные свойства [15]. ИЛ-4 ингибирует продукцию провоспалительных медиаторов, таких как ФНО-а, ИЛ-1 и ИЛ-12 [3, 7], способствует увеличению продукции антагонистов рецептора ИЛ-1 и растворимых рецепторов ФНО [7], подавляет пролиферацию и провоспалительную активность фибробластов [8]. Он способен подавлять продукцию васкуло-эндотелиального фактора роста (ВЭФР) синовиальными фибробластами, а также регулировать тканевую деструкцию при артрите посредством ингибирования спонтанной и стимулированной продукции матриксной металлопротеиназы-1 синовиоцитами [15]. Таким образом, ИЛ-4 является важным регулятором тяжести артрита.
Инфильтрация синовия воспалительными клетками осуществляется, в частности, посредством цитокина ИЛ-8. Главным источником ИЛ-8 являются моноциты, макрофаги [10, 13] а также нейтрофилы, фибробласты, эпителиальные, эндотелиальные и мезотелиальные клетки [2]. ИЛ-8 выделяется эпителиальными клетками в ответ на оксидативный стресс [11]. ИЛ-8 хемотактичен для всех известных типов мигрирующих иммунных клеток: он привлекает нейтрофилы, лимфоциты, лейкоциты и моноциты в синовии, а также способен рекрутировать Т-клетки, фибробласты [9, 11]. Подлежащие молекулярные механизмы включают экспрессию интегринов и сбрасывание L-селектина, реорганизацию цитоскелета, дегрануляцию цитокинов и фагоцитоз, производство протеаз и других воспалительных медиаторов [13].
ИЛ-8 отличается от всех остальных цитокинов своей способностью специфически активировать нейтрофильные гранулоциты, что ведет к освобождению энзимов из гранул. ИЛ-8 также усиливает метаболизм активных форм кислорода и увеличивает хемотаксис и экспрессию молекул адгезии [11]. Есть вероятность, что ИЛ-8 непосредственно модулирует эндотелиальную пролиферацию и миграцию, регулирует ангиогенез, способствует дифференцировке фибробластов в миофибробласты [9, 11]. Свои проангиогенные свойства по отношению к эндотелиальным клеткам сосудов ИЛ-8 делит с ВЭФР [6, 9].
Существует все больше доказательств того, что статины обладают противовоспалительными и иммуномодуляторными свойствами, независимо от их холестериноснижающего эффекта, о чем свидетельствует снижение уровня С-реактивного белка (СРБ) при РА [5]. Таким образом, статины могут оказаться полезными для лечения пациентов с РА.
Учитывая все вышеизложенное, тема данного научного исследования является актуальной.
Цель исследования – изучить состояние показателей цитокиновой системы крови (ИЛ-4, ИЛ-8) у больных РА в зависимости от активности воспалительного процесса, клинической формы, рентгенологической стадии, длительности заболевания, а также их динамику под влиянием фармакотерапии.
Материал и методы исследования
Обследовано 58 женщин, больных РА, в возрасте 54 (48; 62) лет. Группа сравнения составила 17 здоровых женщин. При постановке диагноза руководствовались критериями AСR 1987 г. Длительность заболевания составляла от 1,5 месяцев до 34 лет.
По степени активности больные РА были распределены следующим образом: I степень активности была зафиксирована у 8 (13,79 %) пациенток, II степень активности процесса – у 23 (39,66 %) больных, III степень – у 27 (46,55 %). Системные проявления РА были обнаружены у 31 больных (53,45 %) в виде: амиотрофии – 20 (34,48 %); ревматоидных узелков – 12 (20,69 %); лимфаденопатии – 7 (12,07 %); анемии – 6 (10,34 %); кожного васкулита – 6 (10,34 %); гепатолиенального синдрома – 3 (5,17 %); невропатии – 3 (5,17 %); синдрома Рейно – 2 (3,45 %); ксерофтальмии – 2 (3,45 %). РА по типу полиартрита был выявлен у 58 пациенток (100 %). У 10 (17,24 %) больных зафиксирован ранний ревматоидный артрит с длительностью от 1,5 месяцев до 1 года. По рентгенологической стадии РА (по Штейнброкеру) больные были распределены следующим образом: I и II стадии – 33 (56,9 %), III и IV стадии – 25 (43,1 %). Серопозитивный вариант был выявлен у 44 пациенток (75,86 %), серонегативный – у 14 (24,14 %) пациенток. Больные с системными проявлениями составили в группе серопозитивных больных 63,64 %. Функциональная недостаточность суставов при РА I степени составила 10 (17,24 %), II степени – 38 (65,52 %), III степени – 10 (17,24 %) пациенток.
Объем исследования больных включал в себя анамнез, объективное исследование с помощью физических методов: суставной индекс Ричи, суставной счет, число воспаленных суставов, окружность проксимальных межфаланговых суставов, ВАШ, опросник здоровья HAQ. Для оценки активности заболевания использовался индекс активности болезни (Disease Activity Score-4). Всем больным проводилось лабораторное и инструментальное исследование, включающее общий анализ крови и мочи, определение С-реактивного белка (СРБ), ревматоидного фактора, рентгенологическое исследование пораженных суставов. Больным в динамике через 3 месяца определяли уровень сывороточных цитокинов (ИЛ-4, ИЛ-8) методом твердофазного иммуноферментного анализа с использованием стандартных коммерческих наборов реактивов «Интерлейкин-4-ИФА-БЕСТ» и «Интерлейкин-8-ИФА-Бест» («ЗАО Вектор-Бест», Новосибирск).
При статистической обработке материала использовались методы непараметрической статистики (критерий Вилкоксона, критерий знаков, критерий Манна‒Уитни). Достоверным считалось различие при p < 0,05. Обраборка результатов исследования проводилась в программе Statistica 10.0.
Результаты исследования и их обсуждение
У больных РА по сравнению со здоровыми отмечается достоверное увеличение как провоспалительного ИЛ-8 (p < 0,05), так и противовоспалительного ИЛ-4 (p < 0,01), последнее, вероятно, отображает стремление Tх2 подавлять реактивность активированных CD4+ Т-лимфоцитов по Th1 типу, которые характеризуются продукцией провоспалительных цитокинов. Подобные результаты были получены в работе Meyer P.W.A. et al., 2010 [8].
При II и III степени активности РА отмечается достоверное уменьшение ИЛ-4 по сравнению с I степенью активности (таблица). При III степени активности уровень ИЛ-4 уменьшается в 1,92 раза по сравнению с I степенью активности. Вероятно, это связано с истощением противовоспалительного ответа, таким образом, система противовоспалительного ответа теряет силу противодействия воспалительной реакции.
Определение показателей ИЛ-4 и ИЛ-8 крови у больных РА
|
Контингент обследованных |
ИЛ-4 пг/мл Mе (25 %; 75 %) |
ИЛ-8 пг/мл Mе (25 %; 75 %) |
|
1. Здоровые n = 17 |
3,5 (2;5,2) |
3,2 (2,3;4,9) |
|
Больные РА 2. I степень активности n = 8 p (2,1) p (2,3) |
14,4 (10,45; 29,5) p < 0,01 p > 0,05 |
9,15 (4,35; 15,35) p < 0,05 p > 0,05 |
|
3. II степень активности n = 23 p (3,1) p (3,4) |
10 (6,2; 14,7) p < 0,01 p > 0,05 |
16,5 (9; 40,7) p < 0,01 p < 0,01 |
|
4. III степень активности n = 27 p (4,1) p (4,2) |
7,5 (3,6; 14,6) p < 0,01 p < 0,05 |
32,3 (27,9; 47,5) p < 0,01 p < 0,01 |
|
5. Серопозитивные n = 44 |
7,9 (4,95; 16,05) |
28,7 (16,55; 42,6) |
|
6. Серонегативные n = 14 p (5,6) |
12,65 (8,7; 14,8) p > 0,05 |
13,3 (6,8; 28,1) p < 0,05 |
|
7. РА без системных проявлений n = 27 p (7,8) |
9,4 (6,2; 17,4) p > 0,05 |
25,3 (7,3; 34,6) p > 0,05 |
|
8. РА с системными проявлениями n = 31 |
7,9 (4,7; 14,7) |
28,6 (17,1; 41,7) |
|
9. I + II рентгенологические стадии n = 33 p (9,10) |
10 (6,2; 26) p > 0,05 |
28,8 (16,5; 41,7) p > 0,05 |
|
10. III+IV рентгенологические стадии n = 25 |
8 (5; 13,2) |
20 (11,3; 37,1) |
По мере роста активности отмечается увеличение ИЛ-8 крови. При III степени активности отмечается достоверное увеличение ИЛ-8 по сравнению с I степенью активности (p < 0,05). При I степени уровень ИЛ-8 крови составлял 9,15, при II – 16,5, при III – 32,3 (см. таблицу). Таким образом, отмечалось увеличение ИЛ-8 при III степени в 3,4 по сравнению с I степенью активности воспалительного процесса. Можно предполагать, что чем выше активность, тем выше уровень цитокинового ответа и больше повреждение тканей с деструктивными изменениями. Определение уровней ИЛ-4 и ИЛ-8 может быть использовано как дополнительный показатель для определения активности воспалительного процесса.
При серопозитивном РА по сравнению с серонегативным имеется тенденция к снижению ИЛ-4 (p > 0,05), в то время как ИЛ-8 достоверно выше при серопозитивных формах по сравнению с серонегативными (p < 0,05), что, вероятно, обусловлено более тяжелым течением серопозитивных вариантов РА.
Не выявлено достоверных изменений ИЛ-4 и ИЛ-8 крови в зависимости от системности процесса и от рентгенологической стадии (см. таблицу).
Пациенты с ранним РА имеют более высокий уровень ИЛ-8 по сравнению с большей длительностью болезни (49,45 (30,7; 93) и 21,5 (10,6; 34,55) соответственно; p < 0,001), что свидетельствует об активации нейтрофилов и их активном рекрутировании в очаг воспаления с самого начала заболевания.
Больные РА были рандомизированы на две репрезентативные группы. Больным I группы было проведено лечение: преднизолон в дозе 10–15 мг/сут., метотрексат в дозе 12,5 мг/нед., аторвастатин в дозе 20 мг/сут. Пациенты II группы получали только преднизолон и метотрексат в аналогичных дозах. Больные были обследованы в динамике через 3 мес. (рисунок).
В I группе пациентов в динамике через 3 мес. после лечения уровень ИЛ-4 крови был достоверно выше по сравнению с исходным (p < 0,01), что связано с уменьшением воспалительного процесса. По данным Chodick G. et al. 2010, это обусловлено тем, что статины влияют на секрецию цитокинов в пользу противовоспалительных Тх2 цитокинов.
В I группе пациентов отмечалась достоверная динамика уменьшения ИЛ-8 крови в 2,24 раза (p < 0,01), что связано с положительным клиническим эффектом и уменьшением воспалительной реакции под влиянием аторвастатина. Аторвастатин обладает противовоспалительным, иммуномодуляторным, антиатеросклеротическим эффектом. Во II группе больных РА достоверных изменений изучаемых показателей не выявлено (p > 0,05). В обеих группах после лечения не отмечалось нормализации изучаемых показателей по сравнению с контролем.
Определение уровня ИЛ-4 и ИЛ-8 крови может быть использовано в качестве дополнительного критерия определения эффективности фармакотерапии.
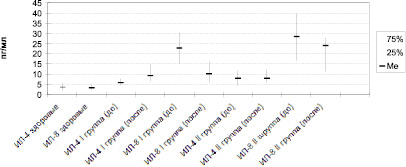
Динамика показателей ИЛ-4 и ИЛ-8 крови у больных РА под влиянием фармакотерапии
Выводы
У больных РА отмечается увеличение уровня провоспалительного цитокина ИЛ-8 крови по сравнению с нормой. По мере нарастания степени активности заболевания зафиксировано повышение ИЛ-8 крови, что может быть использовано в качестве информативного критерия для оценки активности воспалительного процесса. ИЛ-8 был достоверно выше при раннем РА, что может быть использовано для диагностики РА на раннем этапе.
У больных РА отмечается увеличение противовоспалительного цитокина ИЛ-4 крови по сравнению с нормой. Отмечено снижение уровня ИЛ-4 крови соответственно степени активности заболевания, что свидетельствует об истощении защитных сил организма при нарастании воспалительного процесса. ИЛ-4 крови может быть использован в качестве информативного теста для оценки активности воспалительного процесса.
В динамике через 3 мес. наряду с положительным клиническим эффектом у больных РА первой группы под влиянием фармакотерапии преднизолоном в сочетании с метотрексатом и аторвастатином имеет место достоверное снижение уровня ИЛ-8 с достоверным увеличением ИЛ-4 крови. Эти показатели могут быть использованы для оценки эффективности фармакотерапии. Включение в комплекс лечения аторвастатина оказывает более выраженный клинический эффект, так как аторвастатин обладает противовоспалительным, иммуномодулирующим эффектом. Для увеличения эффективности фармакотерапии рекомендуется включение аторвастатина в комплексную терапию РА.
Рецензенты:
Кратнов А.Е., д.м.н., профессор, зав. кафедрой терапии педиатрического факультета, ГОУ ВПО «Ярославская государственная медицинская академия», г. Ярославль;
Данилова Т.Г., д.м.н., профессор кафедры терапии Института последипломного образования врачей, ГОУ ВПО «Ярославская государственная медицинская академия», г. Ярославль.
Работа поступила в редакцию 07.03.2013.


