Органические фотохромные соединения на протяжении нескольких десятилетий привлекают к себе неослабевающий интерес благодаря возможности обратимой трансформации под действием электромагнитного излучения между двумя формами, обладающими различными картинами спектрального поглощения. Данное явление известно как фотохромизм, и именно на его базе возможно потенциальное использование органических фотохромов в целом ряде наукоемких областей – от хемосенсорики до молекулярной электроники [6].
Одним из наиболее важных и интересных классов органических фотохромных соединений являются спиропираны (1) – гетероциклические соединения, в которых две части молекулы (гетареновая и 2Н-хроменовая) соединены с помощью спиро-атома углерода. Под действием активирующего излучения стерически-напряженная связь Сспиро – О может подвергаться разрыву, а молекула спиропирана переходить из закрытой спироциклической формы в изомерную ей открытую мероцианиновую форму (рис. 1).
Бис-спиропираны имеют 2 фотоактивных центра в молекуле, а следовательно, сразу 4 изомерные формы, что делает их потенциальными прототипами мультипозиционных молекулярных переключателей.
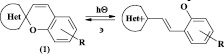
Рис. 1. Общая схема изомеризации спиропиранов
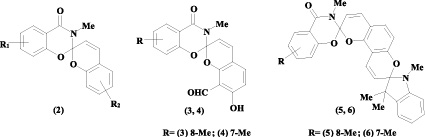
Цель исследования. Ранее в нашей лаборатории были получены систематические серии моно- и бис-спиропиранов ряда 1,3-бензоксазин-4-она (2) с различно модифицированными гетареновой и бензопирановой компонентами. Предыдущие исследования позволили определить, что введение акцепторных заместителей в 2Н-хроменовую часть (положения 6’ и 8’) приводит к увеличению фотоактивности [5], в то время как модификация ими оксазиновой части ухудшает фотохромные свойства соединения. Логично было предположить, что наличие донорных заместителей в гетареновом фрагменте должно привести к стабилизации открытой формы спиропирана за счет улучшения делокализации избыточного положительного заряда, образующегося в данной части молекулы при фотоиндуцированном образовании мероцианиновой изомерной формы. Стабилизация мероцианинового изомера, в свою очередь, означает увеличение таких важных фотодинамических параметров соединения, как время жизни открытой формы и квантовый выход фотоизомеризации.
Таким образом, целью нашего исследования стало получение новых спиропиранов (3, 4) и бис-спироструктур на их основе (5, 6), содержащих донорные заместители в разных положениях оксазинового фрагмента, а также изучение влияния данной модификации на фотохромные свойства синтезированных соединений.
Результаты исследования и их обсуждение
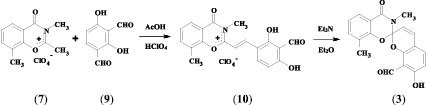
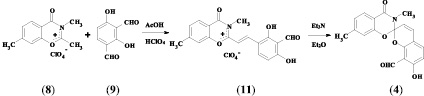
Для конструирования гетероциклических архитектур, необходимых для создания гетареновой части целевых спиросоединений, использовались перхлораты бензоксазинония (7, 8), синтезированные на основе 3-метил- и 4-метилсалициловых кислот известным способом [2].
Целевые спиропираны (3, 4) были получены при взаимодействии 2,4-дигидрокси-изо-фталевого альдегида (9) и соответствующих гетероциклических перхлоратов по 2-стадийной методике, предусматривающей выделение промежуточных стирильных солей (10, 11) и их циклизацию под действием триэтиламина в диэтиловом эфире.
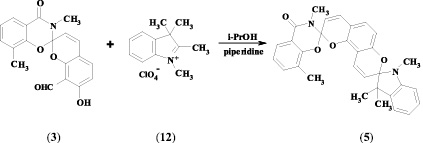
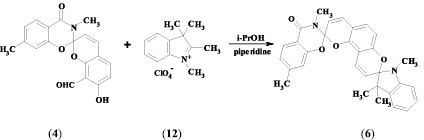
Наличие в полученных спиропиранах орто-расположенных гидрокси- и альдегидной групп позволило использовать их в качестве аналогов салицилового альдегида для синтеза целевых бисспиросоединений. Бисспиропираны (5, 6) были синтезированы при кипячении соединений (3, 4) с перхлоратом индоленилия (12) в изопропиловом спирте в присутствии пиперидина.
Структура полученных соединений подтверждена с помощью методов ЯМР 1Н и ИК-спектроскопии.
Были проведены предварительные фотохимические исследования синтезированных спиросоединений. Оказалось, что спиропираны (3, 4) не проявляют фотохромных свойств при облучении их толуольных и ацетонитрильных растворов белым нефильтрованным светом. Это наблюдение можно объяснить, предположив, что наличие электронодонорной гидрокисльной группы в положении 7’ уменьшает поляризационное действие альдегидной группы на связь Сспиро – О, что делает ее более прочной и уменьшает вероятность ее фотоинициированного разрыва.
Бис-спиросоединения в аналогичных условиях проявляют фотохромную активность. При облучении ацетонитрильного раствора бис-спиропирана (6) УФ-светом с длиной волны 313 нм в спектре электронного поглощения наблюдалось образование максимумов длинноволнового поглощения, свидетельствующих об образовании открытых мероцианиновых форм данного соединения (рис. 2).
Исходя из наших предыдущих исследований [1, 3, 4], можно предположить, что максимум поглощения 600 нм соответствует однократно открытому бис-спиропирану, равно как и поглощение в районе 410 нм, характерное для индолиновых спиропиранов. Рассчитанное время жизни открытой формы соединения составило 97 с. Этот показатель более чем в 3 раза превосходит значение данной характеристики у подобных соединений, полученных ранее и не содержащих донорных заместителей в гетареновой части. Данный факт позволяет говорить о стабилизации открытой изомерной формы бис-спиросоединения при введении электронодонорного заместителя в гетареновый фрагмент, однако для однозначности выводов необходимы дальнейшие фотохимические исследования с использованием различных растворителей.
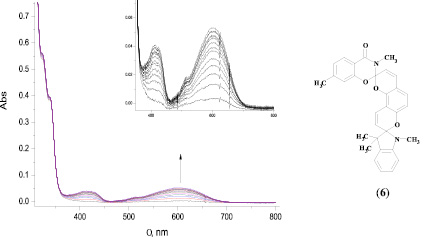
Рис. 2. УФ-спектр поглощения бис-спиропирана (6) в ацетонитриле до и после облучения в стационарном режиме светом с λmax = 313 нм при t = 20 °C
Заключение
В рамках модификации гетареновой части спиропиранов донорными заместителями были получены моно- и бис-спиросоедения, содержащие метильные заместители в оксазиновой части. Бис-спиросоединения показывают фотохромную активность при облучении УФ-светом в стационарном режиме. Предварительные фотохимические исследования одного из бис-спиропиранов позволяют судить о положительном влиянии введения донорных заместителей в оксазиновую часть молекулы на фотохромные свойства соединения, что заключается в увеличении времени жизни открытой формы молекулы по сравнению с полученными ранее результатами.
Экспериментальная часть
ИК-спектры поглощения регистрировались на инфракрасном Фурье-спектрометре (Excalibur HE 3100, PC). Съемка электронных спектров поглощения проводилась в ацетонитрильных и толуольных растворах на спектрофотометре Cary 100 Scan Varian. В качестве источника облучения применялась ртутная лампа ДРШ-250 с использованием стандартного набора фильтров. Съемка спектров ЯМР 1Н проводилась на радиоспектрометре Bruker 250 (250 MГц) в импульсном Фурье-режиме в дейтерохлороформе.
7’-гидрокси-8’-формил-3,8-диметил-4-оксо-спиро(1,3-бензоксазин-2-2’-[2H]-хромен) (3). К горячему раствору 1,66 г (0,01 М) 2,4-дигидрокси-изо-фталевого альдегида (9) в 10 мл уксусной кислоты прибавили 2,9 г (0,01 М) перхлората 2,3,8-триметил-1,3-бензоксазин-4-ония (7). Реакционную смесь кипятили около 7 минут, затем герметично закрыли и оставили на ночь. Выпавший ярко-оранжевый осадок стирильной соли отфильтровали и промыли этиловым эфиром (3∙15 мл). Поместили соль в абсолютный этиловый эфир (50 мл) и по каплям добавили эквимолярное количество триэтиламина. Через 12 часов эфир декантировали, растворитель отогнали, остаток перекристаллизовали из этилового спирта. Выход – 29 %. Tпл = 169 °С. ИК-спектр, ν, см–1: 1677 (С = О); 1647, 1600 (С = С); 949, 921 (Сспиро–О). Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 2,01 (3 Н, с, 8-СН3), 3,17 (3 Н, с, N–СН3), 5,98 (1 Н, д, J = 9,8, 3′-Н), 6,60 (1 Н, д, J = 8,6, 6′-Н), 6.92 (1Н, д, J = 9,8, 4′-Н), 7.07 (1 Н, т, 6–Н), 7.30 (1 Н, д, 7-Н), 7.37 (1 Н, д, J = 8,6, 5′-Н), 7,88 (1 Н, д, 5-Н), 9,78 (1 Н, с, 8′-СНО), 11,68 (1 Н, сш, 7′-ОН).
7’-гидрокси-8’-формил-3,7-диметил-4-оксо-спиро(1,3-бензоксазин-2-2’-[2H]-хромен) (4). Получили по методике, аналогичной синтезу соединения (3), на основе 2,4-дигидрокси-изо-фталевого альдегида (9) и перхлората 2,3,7-триметил-1,3-бензоксазин-4-ония (8). Выход – 30 %. Tпл = 177 °С. ИК-спектр, ν, см–1: 1683 (С = О); 1636, 1608 (С = С); 949, 929 (Сспиро–О). Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 2,32 (3 Н, с, 7-СН3), 3,15 (3Н, с, N-СН3), 5,95 (1 Н, д, J = 9,8, 3′-Н), 6,60 (1 Н, д, J = 8,6, 6′-Н), 6.67 (1 Н, с, 8-Н), 6,9 (1Н, д, J = 9,8, 4′-Н), 6.98 (1 Н, д, J = 7,9, 6-Н), 7.36 (1 Н, д, J = 8,6, 5′-Н), 7,91 (1 Н, д, J = 7,9, 5-Н), 9,84 (1 Н, с, 8′-СНО), 11,69 (1 Н, с, 7′-ОН).
3,8-диметил-4-оксо-2Н-1,3-бензоксазин-2-спиро-2′H,8′H-пирано-[2,3-f]хромен-8′-спиро-2′′-1′′,3′′,3′′-триметилиндолин (5). 0,355 г (1 ммоль) спиропирана (3) и 0,274 г (1 ммоль) перхлората индоленилия (12) растворили в 10 мл изопропанола. К полученной смеси прилили по каплям при нагревании 0,1 мл (0,0011 М) пиперидина. Кипятили около 10 минут, оставили в темном месте на ночь. Отфильтровали выпавший осадок, промыли минимальным количеством гексана. Выход – 74 %. Tпл = 157 °С. ИК-спектр, ν, см–1: 1675 (С = О); 1604 (С = С); 950, 925 (Сспиро–О). Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1,07 (3 Н, д, 3′′-СН3), 1,23 (3 Н, д, 3′′-СН3), 2,0 (3 Н, д, 8-СН3), 2,63 (3 Н, д, 1′′-СН3), 3,17 (3 Н, с, 3-СН3), 5,5 (1 Н, дд, J = 10,4, 9′-Н), 5,9 (1 Н, J = 9,7, 3′-Н), 6,39 (1 Н, д, J = 8,4, 6′-Н), 6.48 (1 Н, д, J = 7,7, 7′′-Н), 6,6–6,7 (1 Н, дд, J = 10,4, 10′-Н), 6,8 (1 Н, т, J = 7,3, J = 7,6, 6-Н), 6,9 (1 Н, J = 9,7, 4′-Н), 6,95 (1 Н, J = 8,4, 5′-Н), 7,02–7,17 (3 Н, м, 4′′-Н, 5′′-Н, 6′′-Н), 7,31 (1 Н, д, J = 7,3, 7-Н), 7,91 (1 Н, д, J = 7,6, 5-Н).
3,7-диметил-4-оксо-2Н-1,3-бензоксазин-2-спиро-2′H,8′H-пирано-[2,3-f]хромен-8′-спиро-2′′-1′′,3′′,3′′-триметилиндолин (6). Получили по методике, аналогичной синтезу соединения (5), на основе спиросоединения (4). Выход – 80 %. Tпл = 230 °С. ИК-спектр, ν, см–1: 1681 (С = О); 1644, 1606 (С = С); 933 (Сспиро–О). Спектр ЯМР 1Н (CDCl3), δ, м. д. (J, Гц): 1,08 (3 Н, д, 3′′-СН3), 1,24 (3 Н, с, 3′′-СН3), 2,34 (3 Н, с, 7-СН3), 2,65 (3 Н, д, 1′′-СН3), 3,14 (3 Н, д, 3-СН3), 5,5 (1 Н, дд, J = 10,4, 9′-Н), 5,84 (1 Н, J = 9,8, 3′-Н), 6,39 (1 Н, д, J = 8,3, 6′-Н), 6.46 (1 Н, д, J = 7,8, 6-Н), 6,67–7,03 (7 Н, м, 8-Н, 4′-Н, 5′-Н, 10′-Н, 4′′-Н, 5′′-Н, 7′′-Н), 7,12 (1 Н, т, 6′′-Н), 7,95 (1 Н, д, J = 7,9, 5-Н).
Исследование выполнено при поддержке Министерства образования и науки Российской Федерации, соглашение 14.132.21.1460, а также гранта РФФИ 12-03-90017_Бел_а.
Рецензенты:
Дубоносов А.Д., д.х.н., главный научный сотрудник, ЮНЦ РАН, г. Ростовна-Дону;
Стариков А.Г., д.х.н., ведущий научный сотрудник, НИИ ФОХ ЮФУ, г. Ростовна-Дону.
Работа поступила в редакцию 15.08.2013.



