В настоящее время титан и его сплавы являются наиболее распространенным материалом для изготовления костных имплантов различного назначения [1]. Это связано с его высокими антикоррозионными свойствами и биологической инертностью. По своей химической стойкости титан значительно превосходит другие традиционные материалы, используемые в имплантологии, такие как нержавеющая сталь, сплавы железа, никеля, хрома и кобальта. Важным фактором является также и то, что титан обладает наиболее близкими к костной ткани механическими свойствами.
С другой стороны, срастанию импланта и костной ткани способствует использование титана (титановых сплавов), имеющих высокую пористость, в частности – изделий, полученных методами порошковой металлургии [2, 3].
Однако пористая структура металла способствует существенному снижению его прочностных характеристик [4].
Другой подход к решению данной проблемы состоит в нанесении на поверхность металлических имплантов покрытий из биосовместимых материалов, структура и свойства которых способствуют срастанию материала импланта и костной ткани [5–7].
В наибольшей степени этим требованиям удовлетворяют покрытия на основе гидроксиапатита (ГА) и трикальцийфосфата (ТКФ), нанесенные биомиметическим методом при относительно низких температурах [8–10].
Особый интерес среди таких методов модифицирования поверхности титаната и его сплавов получил способ модифицирования поверхностных слоев титана и его сплавов путем обработки в водных растворах гидроксида калия при последующем биомиметическом высаживании на полученную поверхность гидроксиапатита [11, 12].
Пористая структура, формируемая при взаимодействии Ti и КОН, состоит из аморфного титаната калия и имеет не слишком высокую пористость, в связи с чем этот метод был усовершенствован за счет проведения химической обработки поверхности не в две, а в три стадии [13, 14]. При этом перед обработкой в водном растворе КОН поверхность титана подвергают травлению к растворе HCl. Данная процедура не только благоприятным образом изменяет морфологию поверхности металла, но и впоследствии способствует ускоренному формированию слоя титаната калия.
Следует отметить, однако, что влияние параметров покрытия, формирующегося на поверхности титана при термохимической обработке водными растворами кислот и щелочей, на механические свойства поверхностного слоя до сих пор не исследовалось. Кроме того, с учетом растущих требований к бактерицидным свойствам поверхности имплантов интерес представляет исследование возможности увеличения этих свойств за счет введения в состав титанатного покрытия малого количества ионов переходных металлов. Решению этих задач и посвящена данная работа.
Материалы и методы исследования
В качестве обрабатываемой подложки были использованы пластины из химически чистого титана, содержащего в качестве примесей, по данным EDS-анализа (масс. %) Ni (0,58), Fe (0,45), Ca (0,20), Cr (0,05).
Подготовка поверхности металла к нанесению покрытия проводилась в соответствии с методикой представленной в работах [13, 14]. Проводилась зачистка поверхности образцов металла мелкозернистой наждачной бумагой с использованием последовательно номеров 400, 600, 800 и 1000. Затем зачищенные образцы промывали в дистиллированной воде. Обезжиривание поверхности проводили техническим этиловым спиртом (чистота 95 %), после чего образцы имплантов помещали в мерный стакан с водным раствором соляной кислоты (концентрация 35,5 %) для травления и формирования на поверхности титана слоя, обладающего повышенной реакционной способностью. Обработку в растворе кислоты проводили в течение 0,25–4,00 часов при 50 °С. Затем осуществляли промывку образцов титана в дистиллированной воде с последующей сушкой при 45 °С. Далее проводили химическую обработку полученных образцов в 5Н водном растворе КОН в течение 24 ч при 60 °С.
Строение и химический состав поверхности образцов титана, полученных после каждой из стадий химической обработки, исследовали с использованием методов сканирующей электронной микроскопии (растровый электронный микроскоп c совмещенным энергодисперсионным спектрометром X-MAX JEOL JSM-6610 / Oxford Instruments). Величину краевого угла смачивания водой определяли с помощью прибора DSA20 (EasyDrop) KRUSS.
Механические свойства поверхности имплантов исследовали с помощью измерительного комплекса CSM Micro Identation Tester MHTX S/N 01-2476 (Вискерс) при значениях скорости нагружения алмазной пирамидки и скорости обратного хода равных 60 мН/мин, время выдержки под нагрузкой 15 с, прижимная сила контакта 15 мН, максимальная дополнительная нагрузка 30 мН). При этом определялись следующие характеристики поверхности: твердость вдавливания (Hit); модуль вдавливания (Eit); сопротивление материала пластической деформации (Hit3/Eit2); сопротивление материала упругой деформации разрушения (Hit/Eit), максимальная глубина вдавливания (hmax); остаточная глубина вдавливания после снятия нагрузки (hp); упругое восстановление (Re = (hmax – hp)/hmax); микротвердость по Викерсу (HV). Расчеты велись на основании результатов 6 измерений для каждого образца.
Для формирования на модифицированной поверхности титана биосовместимого покрытия использовали модельный раствор, имитирующий состав плазмы крови (SBF), приготовленный согласно [10] и содержащий на 1 л раствора (г): NaCl (8,035), NaHCO3 (0,355), KCl (0,255), K2HPO4·H2O (0,231), MgCl2·H2O (0,311), 1,0 M HCl (39 мл), CaCl2 (0,292), Na2SO4 (0,072).
Результаты исследования и их обсуждение
Для определения оптимального времени травления образцов титана в растворе соляной кислоты проводили исследование зависимости краевого угла смачивания водой образцов, полученных при различном времени травления. Известно, что увеличение краевого угла смачивания одного и того же материала связано с изменением морфологии поверхности, в частности – с появлением на ней наноразмерных выступов. Полученные результаты (рис. 1) показывают, что при увеличении времени травления равновесное значение краевого угла смачивания водой по мере увеличения времени травления растет от 68 до 99° (1 ч травления), а затем – его величина снижается до 62°. Учитывая, что формирование покрытия с более развитой поверхностью благоприятствует созданию условий для срастания импланта и костной ткани, в дальнейшем для многостадийной обработки использовали образцы из титана после кислотного травления в течение 1 ч.
Общая схема химических реакций, протекающих на поверхности титана при последовательной химической обработке, может быть представлена следующим образом:
1) травление поверхности титана в растворе кислоты
2Ti + 6HCl = 2TiCl3 + 3H2.
При этом выявляются структурные неоднородности поверхности титана и формируется гидридный слой TiHx (1,58 < x < 1,99) [15] толщиной около 1 мкм.
2) взаимодействие поверхности титана с щелочным раствором [4, 16–18]:
TiHx + 3OH- = Ti(OH)3+ + 4e- + x/2 H2;
Ti + 3OH- = Ti(OH)3+ + 4e-;
Ti(OH)3+ + e- = TiO2∙H2O + 1/2 H2;
Ti(OH)3+ + OH- = Ti(OH)4;
Ti(OH)4 = H2TiO3 + H2O;
TiO2·nH2O + OH- = HTiO3-·nH2O;
HTiO3- + K+ = KTiO3;
H2TiO3 + K+ = K2TiO3.



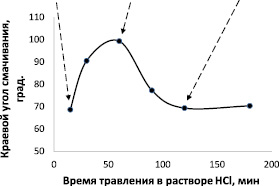
Рис. 1. Влияние времени травления в 35,5 % растворе HCl на величину краевого угла смачивания дистиллированной водой
Образующиеся в результате рассмотренных реакций различные титанаты калия формируют на поверхности титана слой гидрогеля, который при последующей термической обработке (просушивание) подвергается дегидратации и уплотнению с образованием пористого частично гидратированного аморфного титаната калия, являющегося биосовместимым материалом. Как было показано ранее [19], при взаимодействии с водными растворами, имитирующими состав плазмы крови, титанат калия способствует зародышеобразованию кристаллов CaTiO3, которые при последующем замещении Ti на P, преобразуются в кристаллы гидроксиапатита. Последовательность этих превращений отражена на микрофотографиях, представленных на рис. 2.
В таблице приведены данные об изменении механических свойств поверхности титановых имплантов после химической модификации.
Влияние химической модификации на механические свойства поверхности титановых имплантов: 1 – исходный образец титана, 2 – образец после травления в 35,5 % HCl при 50 °С, 3 – образец после травления в кислоте и обработки в 5М растворе КОН (24 ч, 60 °С), 4 – то же, что и 3, но при обработке в растворе КОН в течение 32 ч
|
Номер образца |
Hit, ГПа |
Eit, ГПа |
Hit3/Eit2, ГПа•10–5 |
Hit/Eit, ГПа |
h (max), нм |
h (p), нм |
Re |
HV, Vickers |
|
1 |
4,51 ± 0,91 |
119 ± 17 |
647,7 |
0,0378 |
649 |
509 ± 109 |
21,5 |
425 ± 57 |
|
2 |
3,28 ± 0,40 |
114 ± 9 |
271,5 |
0,0288 |
733 ± 91 |
571 ± 101 |
17,5 |
309 ± 37 |
|
3 |
0,64 ± 0,20 |
53 ± 14 |
10,0 |
0,0121 |
1794 ± 320 |
1617 ± 303 |
9,9 |
60 ± 21 |
|
4 |
0,38 |
29 |
5,9 |
0,0131 |
2739 ± 672 |
2571 ± 550 |
6,1 |
26 ± 8 |
 а
а  б
б
 в
в
Рис. 2. Микрофотографии поверхности титанового импланта после травления в 35,5 % HCl (а), после травления в кислоте и обработки в 5М растворе КОН (б) и после биомиметической обработки (в)
Анализ полученных результатов показывает, что по мере проведения модификации поверхностного слоя снижается его твердость при вдавливании алмазной пирамидки (Hit и HV). Наблюдается также уменьшение Hit/Eit и Hit3/Eit2, характеризующих способность поверхности материала сопротивляться как упругой, так и пластической деформации. Учитывая, что согласно [20] нагрузки сжатия для костных имплантов не превышают 150–200 МПа, можно сделать вывод, что твердость поверхностного слоя имплантов, полученного после двухстадийной химической модификации (640 МПа) – вполне приемлема. При этом следует отметить, что при увеличении толщины биосовместимого титанатного покрытия (увеличении времени обработки в растворе КОН выше 24 ч) – заметно снижается его способность сопротивляться механическим деформациям, что делает нецелесообразным обработку в щелочном растворе более 1 суток.
Несмотря на то, что при обработке снижается величина Re, характеризующая способность структуры поверхностного слоя к упругому восстановлению после деформации; ее величина остается достаточно высокой и соответствует аналогичным характеристикам ряда сталей (10–12 %) [15]. При этом сопротивление поверхностного слоя пластической деформации (Eit) снижается всего в 2 раза. Очевидно, что присутствие на поверхности титана слоя эпитаксиального титанатного покрытия может обеспечить высокую когезию импланта и костной ткани и будет гарантией того, что при механических нагрузках в период срастания не будет происходить отслаивание этого покрытия от поверхности импланта.
Выводы
Изучено формирование структуры эпитаксиального покрытия, формируемого при обработке титановых имплантов последовательно в концентрированных растворах HCl и KOH. Показано, что кислотное травление в 35,5 % HCl при 50 °С в течение 1 ч обеспечивает получение максимально развитой поверхности импланта. Дальнейшее увеличение времени травления приводит к сглаживанию поверхности. Оптимальная толщина биосовместимого покрытия (около 1 мкм), состоящего из аморфных титанатов калия, достигается в ходе последующей обработки титанового импланта в 5 М растворе КОН при 50 °С в течение 24 ч. Увеличение времени обработки способствует отслаиванию покрытия от подложки. Полученное таким образом эпитаксиальное покрытие обладает высокой биосовместимостью и способствует формированию в его порах слоя гидроксиапатита при контакте с физиологическими жидкостями организма. Несмотря на то, что при нанесении биосовместимого покрытия происходит некоторое снижение сопротивления поверхности упругим и пластическим деформациям, механические свойства поверхностных слоев остаются достаточно высокими для предотвращения отслаивания покрытия в период срастания импланта и костной ткани.
Рецензенты:
Решетов В.А., д.т.н., профессор кафедры физической химии, ФГБОУ НИУ СГУ им. Н.Г. Чернышевского, г. Саратов;
Устинова Т.П., д.т.н., профессор, заведующая кафедрой химической технологии Энгельсского технологического института ФГБОУ СГТУ, г. Энгельс.
Работа поступила в редакцию 06.10.2014.



