Наблюдения за животными в естественных условиях обитания свидетельствуют о зависимости их морфологических, физиологических, молекулярных параметров от разных внешних и внутренних факторов, таких как сезон, время суток, флуктуация температур, социальное окружение, динамика пищевых ресурсов и др. Устойчивость любого организма к экстремальным условиям среды заключается в его способности с минимальным ущербом для жизнедеятельности противостоять воздействию внешних факторов, что в конечном итоге приводит к выживанию вида. Особый интерес представляют виды теплокровных, использующие естественное гипобиотическое состояние – зимнюю спячку для адаптации к низким температурам окружающей среды и нехватке пищи.
В последнее десятилетие опубликовано большое количество статей, обзоров и монографий, отражающих самые различные направления исследований зимней спячки т.е. гибернации. Первым исследователем, который привлек внимание дагестанских ученых к изучению гибернации был Гершенович З.С. Наряду с отечественными и зарубежными учеными, работы его последователей – Эмирбекова Э.З., Мейланова И.С., послужили значительным импульсом в понимании механизмов регуляции зимней спячки [9, 13]. Несмотря на более чем полувековую историю интенсивного изучения, молекулярные механизмы зимней спячки остаются загадочными. С учетом отсутствия в литературе и/или наличия только единичных работ, исследование белков клеточного цикла в различных состояниях спячки представляется весьма перспективным направлением.
В обзоре наряду с многочисленными накопленными данными гипотермии приводятся современные сведения о прогрессии клеточного цикла. Интенсивная пролиферативная активность различных тканей гетеротермных и гомойотермных млекопитающих является маркером метаболической активности клеток. В связи с этим знание пролиферативной активности при естественной и вынужденной гипотермии должно способствовать лучшему пониманию проблем гипобиологии, криоконсервации, криомедицины, нейропротекции.
Физиологические особенности гипотермии
Прогресс в исследованиях молекулярных механизмов гибернации в последние десятилетия был в существенной степени обеспечен благодаря использованию истинного (облигатного) гибернанта – суслика в качестве модельного организма. Гибернация – представляет собой состояние оцепенения у животных (торпора), при котором значительно понижается температура тела, замедляются процессы жизнедеятельности, прежде всего обмен веществ. При этом животное снижает энергетические потребности до минимального уровня. Гибернация cостоит из серий баутов, включающих в себя: вступление в торпор → глубокий торпор → выход из него (эутермия). Как только температура тела начинает падать, метаболизм замедляется и животное впадает в оцепенение, причем как теплопродукция, так и температура тела продолжают снижаться. Температура тела животных падает почти до уровня окружающей среды до (5 °С и ниже); очень сильно снижаются метаболизм, дыхание. В таком состоянии они могут сэкономить до 87 % энергии. Частота сердечных сокращений составляет только 5–10 ударов в минуту по сравнению со значением эутермии 350–400 ударов в минуту. Дыхание становится эпизодическим, всего 5–10 вдохов и выдохов, после которых наблюдается период остановки дыхания, который может длиться от нескольких минут до часа. Как правило, торпидное состояние с сниженной температурой и метаболизмом длится около 5–15 дней и затем этот период прерывается коротким периодом пробуждения – эутермии, которая требует значительной траты энергии, пока температура тела не достигнет нормального уровня. При этом температура тела поднимается за несколько часов до 36–37 °С. У мелких млекопитающих поддержание высокой температуры тела происходит за счет высокой интенсивности метаболизма. Соответственно, для этих животных гибернация наступает при малодоступности пищи, когда невозможно сохранять активность и высокий уровень метаболизма [1, 6].
Минимализация физиологических функций не приводит к необратимым изменениям. Организм гетеротермных млекопитающих обладает регуляторной системой, обеспечивающей гомеостаз при минимальном, но стабильном уровне обмена веществ. Животные защищены от повреждающего действия гипоперфузии и реперфузии, происходящими при охлаждении/согревании. Ткани гибернантов в условиях низкого кровотока, пониженного давления и повышенной вязкости крови (вследствие низкой температуры) испытывают риск тромбоза. Однако увеличение экспрессии α2-макроглобулина, а также некоторых белков семейства серпинов уменьшают риск свертывания крови путем ингибирования факторов свёртывания крови, тромбина и фибрина [33, 66, 31]. Накопление СО2 в крови способствует снижению рН тканей, подавлению обмена веществ в них и переходу на экономный уровень метаболизма [12, 37].
Интегральным показателем слаженной работы организма при зимней спячке является активность различных отделов головного мозга. Электрофизиологические эксперименты показали, что развитие гибернации у сусликов начинается с торможения коры головного мозга, далее происходит поэтапное выключение подкорковых структур и распространяется на другие отделы центральной нервной системы (ЦНС). Это способствует адаптации нервной деятельности к условиям снижения температуры тела. В обратной последовательности происходит выход из низкотемпературного состояния. Подавление происходит вследствие накопления ГАМК – тормозного медиатора ЦНС. В филогенетически же более древних структурах, в частности в гиппокампе, некоторые нейроны и в глубоком оцепенении сохраняют электрическую активность, характерную для состояния бодрствования. Исследования показали ключевую роль медиальной септальной области мозга в поддержании гибернации. Поддержкой для этих данных служит регистрация тета-ритма в ЭЭГ гиппокамка при пробуждении животного (Walkeretal., 1977). Имеющиеся в литературе экспериментальные данные показывают, что и медиальная преоптическая область и супрахиазматическое ядро гипоталамуса, управляющие циркадными ритмами активности автономной нервной системы, остаются активными в течение всего торпора [4, 55]. Гипоталамус поддерживает функцию гомеостаза и вовлечен во многие потенциально важные процессы для гибернации и подготовки к гибернации, такие как циркадианные ритмы, сон, температура тела, продукция гормонов. Очевидно, что гипоталамус играет важную роль в инициации гибернации и в управлении и поддержании циклов торпор/пробуждение.
В настоящее время активно изучается регуляторная роль внеклеточных пуринов, главным образом аденозина, в регуляции торпора и сна. У млекопитающих гипокретиновые нейроны перифорникального ядра, дорсальной и латеральной области гипоталамуса участвуют в моделировании сна, пробуждении и в поддержании энергетического гомеостаза. Ниже мы еще вернемся к этой теме, а пока хочется отметить, что аденозин может ингибировать гипокретиновые нейроны в латеральном гипоталамусе и тем самым вызывать состояние сна [46]. Сравнение сна и торпора в свете представлений о влиянии различных эндогенных регуляторов на клеточные процессы может иметь определенное значение, так как показано что медленноволновой сон предшествует входу в торпор и выходу из него. В связи с этим предложена гипотеза, что торпор может быть углублением сна. В то же время имеются сведения о снижении температуры мозга в парадоксальном сне при входе в торпор у гибернантов, тогда как для гомойотермных показано повышение температуры [10]. Очевидно, что независимо от исходного стимула именно эндокринная система является «драйвером» биохимических процессов при гибернации.
Физиологическая регуляция входа в торпор и выхода из него, по мнению ряда авторов, может регулироваться автономной нервной системой. Вероятную связь гибернации с симпатической и парасимпатической системами показывают особенности происходящие в организме гибернантов – изменение дыхания, сердечного ритма, оксигенации, скорости кровотока, глюкозы. Паттерны этих изменений предполагают, что при входе в торпор доминирует парасимпатическая нервная система, в то время как при выходе – симпатическая нервная система. Тонус парасимпатической нервной системы замедляет частоту сердечных сокращений, снижает артериальное давление, повышает секрецию инсулина и, соответственно, снижается уровень глюкозы. Повышение же тонуса симпатической нервной системы приводит к усилению сердечных сокращений и учащению ритма, повышению артериального давления вследствие сужения сосудов и увеличению содержания глюкозы в крови [44, 72, 78].
В настоящее время поиск комплекса гуморальных факторов, которые модулируют действие основных медиаторов автономной нервной системы один из интригующих механизмов, способствующий выяснению и пониманию функционального статуса соответствующих эндогенных субстратов для гипотермии.
Молекулярные особенности гипотермии
Гомеостатические и нейрофизиологические принципы гибернации, в основе которых лежат нейрохимические и молекулярно-биологические каскады для перехода из состояния нормотермии в состояние торпора контролируется у гетеротермных животных комплексом, включающим низкомолекулярные нейропептиды, нейрогормоны, среди которых выделяют серотонин, катехоламины, ацетилхолин, ГАМК, биоактивные нейропептиды, другие нейромедиаторы и нейромодуляторы. Наличием гематоэнцефалического барьера (ГЭБ) объясняется то, что многие вещества, циркулирующие в крови, не проникают ни в нейроны, ни в спинномозговую жидкость, но снижение рН крови при гибернации, возможно, делает доступными нейроны для различных веществ. Интересно отметить, что в лабораторных условиях спячку индуцировали для организмов, не входящих в торпор. Так, чернохвостая луговая собака (Cynomy sludovicianus), помещенная в холодную и темную комнату в условиях отсутствия пищи и воды, входила в торпор [23]. Показано, что введение гипотермических факторов, выделенных из мозга, крови и кишечника сусликов, вызывали различные характерные для оцепенения физиологические признаки у организмов, не впадающих в торпор. При этом отмечалось снижение частоты сердечных сокращений, температуры и общего уровня метаболизма [11, 2]. Это доказывает присутствие схожей рецепторной системы у гетеротермных и гомойотермных, а также наличие не одного определенного «триггера», а «пакета триггеров» спячки, вызывающих различные физиологические, биохимические эффекты гипотермии теплокровных.
Исследования Stantonetal с соавторами (Stantonetal, 1982), показывающие участие тиретропинрилизинг-гормона (TRH) и гистамина в эндогенной регуляции гибернации, вероятно, являются доказательством того, что ингибирование симпатической нервной системы является необходимым фактором для успешной гибернации. Было показано накопление этого гормона в некоторых отделах мозга в состоянии торпора и отмечено, чтоTRH индуцирует пробуждение с состояния, когда животные только входят в торпор и с торпора [70]. Туберомамиллярные нейроны заднего гипоталамуса выделяют гистамин при бодрствовании. Парадоксально, но инъекция в гиппокамп гистамина продлевает торпор. Активность гиппокампа, возможно, регулируется через H1- и H2-гистаминовые рецепторы. Показано увеличение экспрессии мРНК Н3-гистаминового рецептора в коре, хвостатом ядре и скорлупе переднего мозга, что может быть связано с сохранением пула для экспрессии белков при пробуждении [62]. Эти данные позволяют предположить важную роль гистамина в спячке, при котором повышение активности гистамин-рилизинг нейронов является важным механизмом ЦНС для поддержания торпора зимоспящих.
В настоящее время значительное внимание уделяется участию аденозинового рецептора А1 (A1AR) в гибернации. Показано, что стимулирование аденозинового рецептора А1 (A1AR) способствует индукции торпора. Это удалось показать при введении в боковой желудочек головного мозга сусликов агонистов этого рецептора [44]. Аденозин также является ключевым триггером процесса ишемического прекондиционирования и модулирует многие физиологические процессы, особенно в сердце.
Результаты работ различных авторов показывают, что в поддержании торпора активно задействованы и опиатные рецепторы. В экспериментах с введением различных агонистов и антогонистов этих рецепторов было показано, что активация опиатных μ-рецепторов необходима для поддержания позднего торпора [71, 3]. При этом агонисты опиатных рецепторов влияли на высвобождение серотонина из срезов гиппокампа и гипоталамуса активных и торпидных сусликов [25]. Подавление дыхания может быть связано с активацией опиатных μ-рецепторов солитарного тракта гипоталамуса. Сопоставление результатов различных исследований приводит к заключению что, несмотря на различные химические структуры, молекулы этих рецепторов могут играть ключевую роль в каскаде событий при гипотермии.
Генетические программы, запускаемые при гибернации
Многие адаптационные изменения на метаболическом уровне в организме гибернантов происходят задолго до спячки. Прегибернационный сезон характеризуется усиленным синтезом гликогена, в конце лета наблюдается увеличение бурой жировой ткани и, соответственно, запаса липидов. Это термогенный орган, обеспечивающий животных средством разогрева во время пробуждения из торпора. Модификация энергетического метаболизма связана с падением активности ключевых ферментов гликолиза, что приводит к снижению скорости углеводного катаболизма и использованию продуктов β-окисления – кетоновых тел в качестве основного «топлива». Гликолиз дает меньшее количество энергии по сравнению с β-окислением, но при этом в единицу времени расходуется и значительно меньшее количество кислорода, предохраняя организм в целом и, клетку в частности от перехода метаболической системы в окислительный стресс. Сердечная мышца, не имея физиологического покоя, 60–80 % энергии получает путем β-окисления, становясь особенно уязвимой в условиях даже минимального кислородного голодания. В митохондриях в результате β-окисления жирных кислот образуется ацетилкоэнзим А, который поступает в цикл Кребса, где и синтезируется АТФ. При дефиците в клетках кислорода в условиях гипоксии метаболизм миокарда меняется. Короткоцепочечные и длинноцепочечные жирные кислоты поступают в митохондрии, но для их окисления кислорода не хватает. В результате недоокисления в кардиомиоцитах могут накапливаться недоокисленные активные формы жирных кислот в виде ацилкарнитина и ацилкоэнзима А. Именно эти метаболиты способны разрушать клеточные мембраны и блокировать доставку АТФ к органеллам клетки. Количество жирных кислот в плазме крови, скелетных мышцах, сердце и печени якутских сусликов увеличивается в сезон гибернации и растет при выходе из оцепенения [8, 19, 69]. Десатуразы жирных кислот при снижении температуры могут включаться и увеличивают количество двойных связей в липидах, что приводит к снижению точки отвердевания мембраны [12]. Жирные кислоты, образующиеся за счет липолиза триглицеридов, – главный источник энергии при гибернации. Межбаутное пробуждение связано с наибольшими затратами энергии по сравнению с другими этапами цикла. В этот период животное начинает использовать запасы топлива с максимальной скоростью. Многие авторы полагают аллостерическое действие жирных кислот как кофакторов митохондриальных UCP-подобных разобщающих белков. UCP1 экспрессируется в бурой жировой ткани, обеспечивая генерацию тепла путем окисления и фосфорилирования при несократительном термогенезе. Гомологи UCP1 в органах представлены UCP2 (печень, почки и др. органы), UCP3 (скелетные мышцы), UCP4 и UCP5 (головной мозг) [51]. В зимний период у сусликов наблюдается увеличение концентрации разобщающих белков UCP2 и UCP3. Развитие и функционирование бурой жировой ткани находится под контролем адренергической системы. Норадреналин управляет термогенными процессами, регулируя производство тепла митохондриями путем активации в бурой жировой ткани белка – разобщителя (UCP1). Бурый жир способствует разогреванию в первую очередь головного и спинного мозга, а также сердца и внутренних органов в области сердца. Была выдвинута гипотеза, согласно которой UCP2 и UCP3 в других органах также позволяют переключать метаболизм с углеводного на жировой [58]. Однако в последнее время накапливаются все больше данных о том, что эти гомологи UCP1 не участвуют в терморегуляции [7]. Показано, что вклад бурого жира в общую теплопродукцию организма не превышает 10 %, а наиболее существенную роль в химическом термогенезе и наибольший объем в теплопродукции обеспечивает скелетная мускулатура, на долю которой при пробуждении приходится более 60 % потребляемого кислорода (Иванов, 1984).
Довольно специфические изменения наблюдаются в сердце гибернантов. Ингибируются Са2+ токи, так же, как и в мозге, в то время как Na+, К+ и СІ– токи в этот период практически не изменяются [15]. Важной особенностью работы сердца гибернантов является то, что во время спячки при значительном падении температуры тела сердце гибернанта сохраняет способность к сокращению, устойчиво к аритмиям и противостоит фибрилляции. Возможно, это связано с тем, что несмотря на уменьшение содержания тайтина у зимоспящих животных отсутствуют нарушения саркомерной структуры и сократительной функции мышц. Исследования Вихлянцева, Кадулаевой (Кадулаева Е.В., 2010) показывают, что одной из причин отсутствия подобных нарушений является сохранение NT-изоформ тайтина, необходимых для поддержания упорядоченной саркомерной структуры и нужного уровня сократительной активности мышц в разные периоды гибернации. Содержание NT-изоформ тайтина в период спячки не изменялось или даже незначительно возрастало. Увеличение белков щелевых контактов – коннексинов в сердце некоторых гибернантов способствует устойчивости ритма сердца при охлаждении [5].
Основные усилия в последние годы направлены на изучение генетических программ, запускаемых в ЦНС в различных периодах спячки зимоспящих. Нейроны и глиальные конституции являются основными клетками ЦНС. Нейроны относятся к клеткам, находящимся в G0 фазе клеточного цикла, т.е в фазе пролиферативного покоя. В последнее время получены доказательства, что и нейроны могут вступать в клеточный цикл при ишемии. Однако, в отличие от астроцитов и микроглии, эктопическая экспрессия белков клеточного цикла в нейронах приводит к их апоптозу. В серии работ, посвященных изучению белков клеточного цикла в нейронах, показана экспрессия в гибнущих нейронах маркеров клеточного цикла – Сyc D, E, B, Cdk2, Cdk1 [21, 75, 76]. Безусловно, существует множество факторов, способных в зрелых нейронах инициировать сценарий клеточного цикла, сопровождающийся клеточной гибелью. Однако о конкретных механизмах такого процесса без дополнительных исследований говорить достаточно сложно. Ohe с соавторами (Ohe C.G., 2007) приводят данные об индукции апоптоза в нейронах, если они не образуют или утрачивают синаптические связи со своими соседями. Как известно, у золотистого суслика вступление в торпор сопровождается 50–60 % потерей синапсов [53]. Структурная реорганизация синапсов и ретракция дендритных щипиков играют существенную роль в поддержании торпора гибернантов. Морфология и формирование щипиков зависит от динамики процессов полимеризации-деполимеризации белков цитоскелета – актиновых филаментов, микротрубочек, нейрофиламентов [27, 35, 42]. Механизмы ретракции дендритных щипиков, происходящие при гибернации, и обратное восстановление при пробуждении, вероятно, основаны на диссоциации и снижении колокализации пресинаптических и постсинаптических белков. Мониторинг таких пресинаптических и постсинаптических белков, как MAP2, Piccolo, PSD95 и синаптофизина, показал, что кластеризация этих белков снижается при низкой температуре и восстанавливается в течение 2-часового пробуждения. Ретракция дендритных щипиков не приводит к апоптозу нейронов гибернантов [43, 52].
Наряду с клетками сердечной и скелетных мышц, нейроны характеризуются чрезвычайно высокой плотностью динамичной митохондриальной сети, что, вероятно, должно привести их чувствительности к нарушениям энергетического обмена в торпоре [61]. Благодаря подавлению активности нейронов происходит адаптация мозга к гипоксии, т.к. потребление кислорода мозгом несколько раз выше по сравнению с другими тканями [26, 43]. Продукция и расход энергии в мозге холодных сусликов сбалансированы, и концентрация АТФ не снижается (Henryetal., 2007). Ближе к концу эутермического пробуждения, так как все энергозависимые процессы снижены, оптимизация клеточного метаболизма достигается путем накопления АТФ в митохондриальном матриксе. Увеличение АТФ может способствовать фосфорилированию ключевых ферментов цикла трикарбоновых кислот, таких как α-кетоглутаратдегидрогеназы, что приводит к редукции синтеза АТФ. Предшественники цикла трикарбоновых кислот (ЦТК), полученные в результате катаболизма аминокислот и кетоновых тел, накапливаются в митохондриях, так как ферменты ЦТК ингибированы. К концу торпора после замедленного использования и истощения АТФ, пируватдегидрогеназа, изоцитратдегидрогеназа, α-кетоглутаратдегидрогеназа дефосфорилируются и активируются. Повышение белков оксидативного фосфорилирования в зимний период приводит к быстрой продукции АТФ при пробуждении из торпора [41]. Здесь также хочется отметить существование анаэробного гликолиза в мозге зимоспящих в период торпора. Увеличение экспрессии гена лактатдегидрогеназы (LDHA) в коре и гипоталамусе подтверждает сохранение в этих областях, наряду с β-окислением, глюкозы в качестве источника энергии при снижении кислорода [20].
Адаптация к определенным условиям обитания проявляется как в изменении общих характеристик генома, так и в наличии генов, продукты которых обеспечивают приспособление организмов к тем или иным условиям. Предполагается, что гибернанты используют дифференциально экспрессированные гены, существующие у большинства млекопитающих. Переключение дифференциальной трансляции от энергозатратного кэпзависимого на механизм внутренней инициации трансляции (IRES – внутренний сайт посадки рибосом) было исследовано в различное время года у золотистого суслика (Spermophilus lateralis). Число IRES-учаcтников, в которые входят шапероны, транскрипционные факторы, стрессовые белки, индикаторы оксидативного стресса, факторы индуцируемые при гипоксии (HIF-1) увеличено при гибернации. Они имеют очень важное значение при входе в торпор, в раннем торпоре и при пробуждении для смягчения повреждений [64].
Снижение общего метаболизма требует наличия механизма экономии и резервирования всех веществ, необходимых для поддержания состояния гибернации. Во время зимней спячки существующие мРНК могут сохраняться в резерве для быстрой трансляции при выходе из торпора. Показано, что у животных происходит хранение мРНК в Р-тельцах цитоплазмы, которые затем либо деградируют, либо используются для последующей трансляции. Возможно, запасание мРНК для окислительного стресса, глюкозной депривации и для глубокой метаболической депрессии – гибернации, имеют одинаковое значение, способствуя аресту транляции в торпоре и быстрой активации синтеза белка при пробуждении [17, 57]. Другими своеобразными депо мРНК при стрессе в цитоплазме клеток млекопитающих являются особые структуры, называемые иногда стресс-гранулами. Представляя комплекс с малыми субъединицами рибосом, с факторами инициации трансляции и другими белками они могут составить основу современной стратегии гибернации. Отмечено, что в клетках млекопитающих возникают контакты между стресс-гранулами и Р-тельцами [18, 77]. На фоне снижения транскрипции и трансляции способность уже экспрессированных белковых молекул длительное время функционировать без нарушений является ключевой особенностью зимоспящих выдерживать длительное охлаждение [32]. Развитие современных методов изучения экспрессии белков позволило обнаружить увеличение сумоилированных, фосфорилированых и других посттрнсаляцинных модификаций белков в различных тканях сусликов при гибернации [74]. Такая обратимая посттрансляционная модификация играет существенную роль в быстрой активации белков при выходе из торпора.
В последнее время у исследователей повышен интерес к роли коротких РНК в поддержании гибернации. Их основная функция заключается в участи в процессах РНК-интерференции, благодаря которым в цитоплазме клетки регулируется активность механизма трансляции разных белков через воздействие на соответствующие мРНК. С открытием новых классов коротких РНК – rasiRNA и piRNA, регулирующих экспрессию на уровне транскрипции, необходимых для формирования неактивного «молчащего» хроматина» (silent chromatin) и участвующих в обеспечении защиты клетки и организма от перемещающихся подвижных элементов (транспозонов), очевидна роль коротких РНК в поддержании стабильного генома [34, 39]. Комплекс микроРНК – мРНК обеспечивает запасание транскриптов до пробуждения, а также помогает подавлению всех АТФ-затратных механизмов в торпоре. Установлено участие микроРНК в регуляции таких важных клеточных процессов, как пролиферация, апоптоз и реакция на стресс. Показано увеличение в сердце белка Dicer в торпоре по сравнению с эутермией, что является индикатором увеличения микроРНК в этом органе. Получены также данные увеличения антиапоптической микроРНК в почках, что связано с подавлением апоптоза в этом органе [50, 59, 67]. Таким образом, РНК-сайлесинг в ответ на различные сигналы внешней и внутренней среды способствует негативной регуляции активности генов, сохраняя временный паттерн для последующей экспрессии после выхода из торпора и поддержания гомеостаза клетки в торпоре. Нет данных относительно сайлесинга транскрипции при гибернации с помощью РНК-интерференции.
В отличие от гомойотермных, различные ткани зимоспящих защищены и от стресса эндоплазматического ретикулума (ЭР) и от активных форм кислорода (АФК). В сердце белок сорцин, взаимодействуя с рианодиновыми рецепторами (RyR2). ингибирует выброс кальция из ЭР и тем самым редуцирует электромеханическое сопряжение [47, 38, 30]. Уменьшение сорцина при гипотермии может быть связана с переходом из свободного в мембранносвязанное состояние. В головном мозге аналогично сорцин, связываясь с мембраной ЭР может блокировать выброс кальция из эндоплазматического ретикулума в период торпора и сильном стрессе в период согревания, выполняя защитную функцию против апоптоза и эксайтотоксичности, опосредованного эндоплазматическим ретикулумом. В ответ на стресс ЭР индуцируется синтез белков шаперонов. БТШ-шапероны индуцируют синтез такого важного белка, как убиквитин, ковалентно связывающегося с денатурированными белками, которые впоследствии разрушаются специальной АТФ-зависимой протеазой. Экспрессия шаперонов HSP70, HPS90 увеличена при входе в торпор и в начале торпора, что может обеспечить толерантность к стрессу. Стресс ЭР служит сигналом к индукции шаперонов семейства GRP, которые повышаются при снижении глюкозы. Показано увеличение GRP78 в мозгу и в бурой жировой ткани S. Tridecemlineatus [24, 49].
Клеточный цикл
На сегодняшний день в литературе мало данных, отражающих связь клеточного цикла с естественной и искусственной гипотермией. Клеточный цикл можно сформулировать как упорядоченный набор событий переходов от G1 → S → G2 → M фазам. Движение клеток через фазы клеточного цикла координируется деятельностью специфических киназ (Cdk) и соответствующих им циклинов (Cyc) (рисунок). На стадии G1/S индуцируются циклины D, Е и А. Для прохождения через стадии G2/M необходимо участие циклинов А и В [45]. Деление клетки контролируется высокоскоординированными механизмами, включающий помимо циклинов, Cdk-активирующей киназы (Cdk – activatingkinase, CAK), ингибиторы Cdk (cyclin – dependent kinaseinhibitor protein, CKI), регуляторные белки фосфатазы Cdc25, а также протеолитические ферменты. Для полной активации комплекса Cyc/Cdk необходимо фосфорилирование Cdk, которое осуществляется в ядре с помощью CAK. Комплекс САК включает субъединицы: Cdk7, циклин H и белок Mat1. Связывание с циклином приводит к конформационным изменениям в Cdk, которые делают возможным фосфорилирование Cdk с помощью CAK. Ключевыми факторами, отвечающими за остановку клеточного цикла в точках G1/S и G2/M, служат ингибиторы циклинзависимых киназ (СKI). Активность cdk контролируется семействами ингибиторов Cip/Kip (p21, p27, p57) и INK4 (p15, p16, p18, p19). INK4 (inhibitors of kinase 4), названные так за их способность специфически ингибировать Cdk4 и Cdk6, и семейством Cip/Kip (cyclin inhibitor protein/kinase inhibitor protein), члены которого подавляют активность комплексов циклин D-, E-, A/Cdk. Белок р53 активирует экспрессию гена р21, который кодирует основной ингибитор циклинзависимых киназ (Vogelstein et al., 1992) [64]. Уровень циклинов и различных паттернов клеточного цикла регулируется убиквитин лигазными комплексами АРС и SCF, обеспечивая переход между фазами клеточного цикла. При возникновении повреждения в G1-, поздней S-, G2-, M-фазах активируется система чекпойнтов, останавливающих клеточный цикл в определенной фазе клеточного цикла для репарации повреждений или для запуска апоптоза [48, 73].
Фаза G1. Вследствие стимуляции пролиферации митогенными стимулами происходит выход клетки из состояния G0 и запуск фазы G1. В фазе G1 работают комплексы Cyc D/Cdk4/6 и Cyc E/Cdk2. Главная функция комплекса Cyc D/Cdk4/6 заключается в фосфорилировании белка ретинобластомы pRb (retinoblastoma tumor suppressor protein, рRb) и активация фактора транскрипции E2F. Фосфорилирование pRb приводит к диссоциации комплекса pRb/E2F, способствуя высвобождению транскрипционного фактора E2F. Далее данный транскрипционный фактор инициирует экспрессию комплекса генов, необходимых для входа в S фазу, среди которых Cyc E и A, ДНК-полимераза, ингибитор раннего митоза Emil [58, 40].
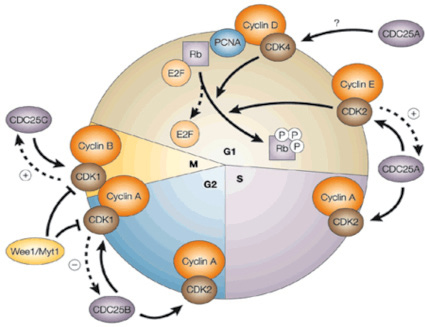
Прогрессия клеточного цикла эукариотической клетки. http://www.nature.com/nrd/journal/v1/n12/fig_tab/nrd963_F3.html
S фаза. Основная программа этой фазы – воспроизведение генетической информации. Удвоение ДНК инициируется на сайтах репликации – множестве ориджинов (ori). На ориджине происходит сборка мультибелкового комплекса ORC. Далее на ORC формируется пререпликативный комплекс (pre-RC), включающий большое количество белков, необходимых для инициации репликации. Формирование pre-RC начинается еще в начале фазы G1.Однократная активация ori на каждом клеточном цикле, т.е. лицензирование, обеспечивается благодаря белкам пререпликативного комплекса и поэтому эти белки еще называют лицензионными факторами репликации. Активация в ранней S фазе Cyc А/CDK2 вызывает последовательное присоединение дополнительных белков к рre-RC и превращение его в преинициаторный комплекс (pre-IC) [22, 28]. Вначале происходит присоединение белка Cdc45. Далее Cdc45 присоединяет к оri ДНК-полимеразу и другие паттерны репликации [14, 41].
G2 фаза. Прохождение клетки через G2 фазу и вход в митоз регулируется комплексом Cyc В/Cdk1. Основными событиями этой фазы являются быстрый рост клетки, экспрессия белков, необходимых в митозе. Импорт в ядро комплекса CycB/Cdk1 инициирует их дефосфорилирование фосфатазой Cdc25С [68]. Дефосфорилированный активный комплекс Cyc В1/Cdk1 запускает фосфорилирование различных мишеней, необходимых для митоза [42, 63].
Митоз. Основным сценарием митоза является точная сегрегация материнских хромосом между дочерними клетками. Как было отмечено выше, события раннего митоза начинаются еще в фазе G2. Комплекс CycВ/Cdk1 фосфорилирует субъединицы ламининов, конденсина, центросомальных белков, белков, ассоциированных с микротрубочками (MAPs), комплекса секурин/сепараза и др. Все это запускает распад ядерной мембраны, сборку митотического веретина деления, конденсацию хромосом, цитокинез и т.д. [65].
Вышеизложенные данные свидетельствуют о наличии любопытных корреляций между пролиферацией и гибернацией. Известно, что при гипотермии клетки могут останавливаться в различных стадиях клеточного цикла, удлиняя время прохождения через фазы. Так, показана остановка клеток тканей мозга в различных фазах в торпидном состоянии сусликов, что, вероятно, связано с снижением метаболизма [60]. Под воздействием веществ, выделенных из мозга сусликов, показано замедление прохождения стадий клеточного цикла в культуре клеток яичника китайского хомячка [16]. Ошибки репликации, необходимость репарации ДНК, снижение биосинтеза белков могут инициировать остановку событий клеточного цикла в тканях гибернантов. Более того, мы предполагаем, что АФК и деление клеток могут инициировать друг друга. Гибернирующие животные могут использовать повышенную пролиферацию клеток в органах в качестве защитной стратегии к гибели клеток. Все это позволяет предложить новый подход к изучению зимней спячки, а также рассмотреть гибернацию в связи с различными проблемами биологии. Понимание общности механизмов клеточного деления и свободнорадикальных процессов в различных тканях гибернантов может иметь фундаментальное значение для ответа на вопросы феномена гибернации.
Заключение
Подводя итог, можно с уверенностью заключить, что все адаптивные сигналы, запускаемые в условиях спячки, инициируют каскад событий для защиты клеток, для перехода на новый уровень сниженного метаболизма с сохранением жизнеспособности в период торпора и для поддержания универсальных событий для выживания в неблагоприятных условиях среды.
Механизмы отрицательного воздействия холода на организм гомойотермных животных продолжает оставаться одной из сложных проблем гипобиологии. Перспективным направлением представляется установление корреляции между пролиферативной активностью, апоптозом и АФК в различных состояниях спячки гибернантов. Из-за постоянного воздействия внешней среды регуляция клеточной пролиферации, а также связь между контролем клеточных делений и развитием организма приобретают пластичность, что дает возможность приспосабливаться и выживать в разнообразных условиях среды. Оценка митотического индекса может послужить базой для решения проблемы холодо-гипоксического воздействия на ткани гомойотермных животных.
Рецензенты:
Исмаилов Э.Ш., д.б.н., профессор кафедры «Химия», ГОУ ВПО «Дагестанский государственный технический университет», г. Махачкала;
Лагарькова М.А., д.б.н., заведующая лабораторией генетики развития, ФГБУН «Институт общей генетики им. Н.И. Вавилова» РАН, г. Москва.
Работа поступила в редакцию 21.10.2014.



