Парасимпатическая регуляция сердца и большинства внутренних органов осуществляется через блуждающие нервы. В составе правого и левого вагуса проходят преганглионарные парасимпатические волокна, чувствительные и двигательные постганглионарные симпатические волокна. Ряд авторов употребляют термины парасимпатическая и вагусная регуляция сердца как синонимы, хотя, на наш взгляд, это неверно. Принято считать, что вагус ингибирует (тормозит) работу сердца. На самом деле парасимпатические преганглионары, проходящие в составе вагуса, образуют возбуждающие синапсы с постганглионарными парасимпатическими нейронами, находящимися в интракардиальных ганглиях, а те уже в свою очередь образуют тормозные синапсы с кардиомиоцитами [11].
Классическими являются эксперименты с перерезкой вагуса, которые вызывают учащение работы сердца и эксперименты со стимуляцией вагуса, приводящие к урежению работы сердца. В наших предыдущих исследованиях мы показали, что ваготомия приводит к кратковременному учащению, после чего наблюдается брадикардия. Перерезка вагуса приводит к серьезным изменениям сердечного ритма, блокада аксонального транспорта в волокнах нерва также оказывает влияние на работу сердца.
Механизм ингибирования сердечной деятельности при взаимодействии ацетилхолина с мускариновыми холинорецепторами изучен достаточно хорошо, однако недавно было показано, что в сердце M-ХР могут активировать NO- синтазу, увеличивая уровень оксида азота. NO активирует гуанилатциклазу. Увеличение внутриклеточной концентрации цГМФ стимулирует фосфодиэстеразу, понижающую концентрацию цАМФ [7, 9].
В то же время активация М-ХР может также вызывать и увеличение цАМФ. Это происходит при активации аденилатциклазы при связывании М-ХР с GS-белком [14, 15].
Исходя из всего вышеизложенного, представляется весьма актуальным изучение содержания NO в тканях различных участков сердца после нарушения целостности блуждающего нерва.
Оксид азота (NO) рассматривается в настоящее время как новая сигнальная молекула, играющая роль универсального регулятора многих физиологических процессов в организме [4, 13]. В жизнедеятельности животных особо значима роль NO в функционировании сердечно-сосудистой [1, 6] и нервной систем [6, 8]. NO контролирует сосудистый тонус, артериальное давление, регулирует сократимость миокарда [4]. Нарушения регуляции мозгового кровотока и снабжения сердца кровью и связанные с ними изменения продукции NO могут приводить к ишемии мозга и сердца с последующим развитием инсульта и инфаркта [10]. Установлено, что NO ухудшает протекание инфаркта миокарда, и это ухудшение заключается в снижении частоты сердечных сокращений, снижении артериального давления, ударного и минутного объемов крови [3]. Существует также противоположная точка зрения, согласно которой избыток NO служит компенсаторным фактором, способствует поддержанию тканевой перфузии и оказывает антиаритмическое действие при реперфузии [2]. Выявлено значительное снижение сердечного выброса, ударного объема крови и печеночной микроциркуляции после введения препаратов, блокирующих активность NO-синтазы [10].
Таким образом, описанные данные литературы свидетельствуют о двух диаметрально противоположных влияниях NO: стимулирующее, положительное, а также токсическое, повреждающее действие, способное приводить к гибели клеток [5]. Поэтому можно предположить, что эффект зависит от количества образующегося NO. Но не ясно, какие количества NO считать небольшими, а какие увеличенными. Вместе с тем отсутствуют данные об уровне продукции NO в предсердиях и желудочках, в рабочем и атипическом миокарде сердца в условиях нормы. При любом подходе к роли NO необходимо иметь в виду, что NO – активный участник процессов метаболизма и резкое изменение его генерации может привести к нарушению функциональной активности многих биосистем.
Исходя из этого, целью исследования явилось изучение роли NO в последствиях, возникающих при острой ваготомии, путем анализа NO-содержащих парамагнитных комплексов в различных отделах сердца крыс, подвергнутых острой ваготомии, а также сравнить эти данные с аналогичными, полученными у интактных животных.
Материал и методы исследования
Исследования проведены на белых лабораторных беспородных крысах стадного разведения, которых разделили на 2 группы: I – контрольная группа, которая содержалась в стандартных условиях вивария (К); II – опытная группа, у которой производилась операция острой ваготомии.
Содержание NO в органах крыс определялось методом ЭПР спектроскопии с использованием спиновой метки; метода, разработанного в институте химической физики РАН профессором А.Ф. Ваниным и сотрудниками [12]. Как и ранее [1], был применен комплекс Fe2+ c диэтилдитиокарбаматом (ДЭТК). Компоненты спиновой ловушки вводятся животному отдельно: ДЭТК-Na вводили внутрибрюшинно в дозе 500 мг/кг в 2,5 мл воды, а смесь растворов: сульфата железа (FeSO4×7 H2O, Sigma, США) в дозе 37,5 мг/кг и цитрата натрия (хч) в дозе 187,5 мг/кг, приготовленную непосредственно перед введением, вводили подкожно в три точки – правое и левое бедро и в холку. В смеси сульфата железа и цитрата натрия образуется цитрат железа. ДЭТК-Na и цитрат железа распределяются по организму и при взаимодействии образуют нерастворимый в воде комплекс ДЭТК-Fe2+, который способен взаимодействовать с NO с образованием стабильного радикала (ДЭТК)2-Fe2+-NO, который может быть зарегистрирован методом электронного парамагнитного резонанса (ЭПР). Через 40 мин после введения препаратов крыс декапитировали. Операции проводили с соблюдением биоэтических норм. В качестве наркоза использовали 25 % раствор уретана из расчета 800 мг/кг массы животного, который вводился внутрибрюшинно. Извлеченные ткани быстро просушивали и замораживали в жидком азоте в специальных капиллярах для измерений. Масса образцов составляла 100 мг. Регистрация спектров ЭПР приготовленных образцов проводилась на спектрометре ЭПР Х-диапазона ER 200E SRC фирмы «Bruker» при температуре 77 К°. Амплитуда модуляции, усиление и мощность СВЧ во всех экспериментах подбирались с условием отсутствия перемодуляции и насыщения сигнала ЭПР и сохранялись одинаковыми на протяжении всех измерений. Количество NO оценивалось по интенсивности характерного сигнала ЭПР, принадлежащего комплексу ((ДЭТК)2-Fe2+-NO). Регистрация и обработка спектров производилась сотрудником КФТИ КНЦ РАН Июдиным В.С.
При статистической обработке получали среднее значение измеряемой величины и стандартную ошибку среднего M ± SEM. Достоверность отличия получаемых значений средних величин проверяли с применением t-критерия Стьюдента и U-критерия Манна – Уитни. Различия считали значимыми при р < 0,05.
Результаты исследования и их обсуждение
Методом ЭПР были изучены ткани желудочков и предсердий сердца контрольных крыс и крыс после острой ваготомии. Во всех измеренных спектрах ЭПР регистрировали характерный триплетный сигнал (рис. 1) от комплекса (ДЭТК)2-Fe2+-NO, интегральная интенсивность которого прямо пропорциональна содержанию NO в образце. Измерения величины интегральной интенсивности спектров ЭПР комплекса (ДЭТК)2-Fe2+-NO показывают, что после острой ваготомии количество NO, образующегося в левом предсердии, увеличивается в 2 раза (рис. 2), однако в тканях левого и правого желудочков и правого предсердия изменений продукции NO не выявлено (рис. 2, 3).
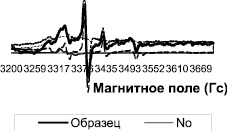
Рис. 1. Спектры ЭПР тканей левого желудочка сердца крыс после острой ваготомии. Ось абсцисс – величина магнитного поля
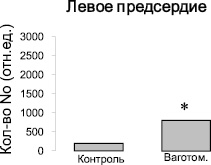
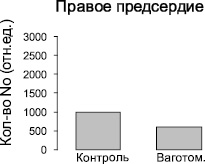
Рис. 2. Изменение количества NO-содержащего парамагнитного комплекса (ДЭТК)2-Fe2+-NO в тканях левого и правого предсердий интактных крыс и крыс после острой ваготомии. Ось ординат – интегральная интенсивность спектра ЭПР, отн.ед. Примечание: * – достоверность по сравнению с показателями контрольной группы: р < 0,05
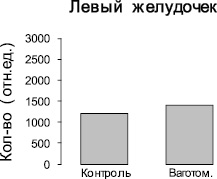
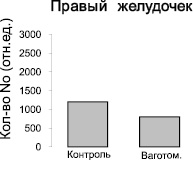
Рис. 3. Изменение количества NO-содержащего парамагнитного комплекса (ДЭТК)2-Fe2+-NO в тканях левого и правого желудочков интактных крыс и крыс после острой ваготомии. Ось ординат – интегральная интенсивность спектра ЭПР, отн.ед.
Известно, что преганглионарные парасимпатические волокна, проходящие в составе блуждающих нервов, заканчиваются в тканях предсердий. В миокарде желудочков холинергические волокна представлены в меньшей степени. Поэтому изменение содержания NO в миокарде левого предсердия, выявленное в наших экспериментах с острой ваготомией, представляется весьма обоснованным. В то же время необходимо отметить, что перерезка левого блуждающего нерва, которая производилась нами в ранее произведенных экспериментах, также вызывала существенные изменения функционального состояния сердца крыс. Состояние и интенсивность каскадов внутриклеточных биохимических реакций при избирательной, острой и хронической ваготомии остаются до конца не изученными. Исходя из этого изменение содержания NO в тканях сердца после ваготомии и блокады аксонального транспорта требует дальнейших исследований.
Выводы
1. Методом ЭПР спектроскопии на основе измерений величины интегральной интенсивности спектров комплекса (ДЭТК)2-Fe2+ -NO показано, что после острой ваготомии у крыс количество NO, образующегося в левом предсердии, увеличивается в 2 раза относительно интактных животных.
2. При острой ваготомии у крыс не выявлено изменений продукции NO в тканях левого и правого желудочков.
Работа выполнена при поддержке РФФИ (грант № 13-04-97082-р).
Рецензенты:
Шайхелисламова М.В., д.б.н., профессор кафедры анатомии, физиологии и охраны здоровья человека, ФГАОУ ВПО «Казанский (Приволжский) федеральный университет», г. Казань;
Биктемирова Р.Г., д.м.н., профессор кафедры анатомии, физиологии и охраны здоровья человека, ФГАОУ ВПО «Казанский (Приволжский) федеральный университет», г. Казань.
Работа поступила в редакцию 23.10.2014.



